При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону Гаусса проводили, розраховуючи показники асиметрії та ексцесу. Однорідність груп визначали за середніми величинами та дисперсіями. Порівняння часток проводили за допомогою критерію Фішера. Для статистичної оцінки розходжень, що спостерігалися між емпіричними та теоретичними частотами варіаційного ряду, використовували критерій χ2 . Зв’язок між кількісними нормально розподіленими показниками оцінювали за допомогою коефіцієнта кореляції Пірсона. Для визначення зв’язку між якісною ознакою з двома варіантами та кількісною ознакою використовували бісеріальний коефіцієнт кореляції (Лакин Г.Ф., 1990). Асоціацію захворювання зі статтю визначали за допомогою тетрахоричного показника зв’язку. Порівняння груп за кількісними ознаками, що нормально розподіляються, проводили за допомогою критерію Ст’юдента. Для порівняння декількох груп використовували однофакторний дисперсійний аналіз (Плохинский Н.А., 1970). Для визначення типу дисліпідемії проведено факторний аналіз (Дюк В., 1997).Висновок про силу зв’язку між генетичними маркерами та захворюванням робили на підставі розрахунку показника відносного ризику (RR), який показує, у скільки разів специфічність ДНК, що тестована на роль маркера, частіше (рідше) зустрічається в одній із груп, порівняно з іншою (ArmitageP.etal., 1994). Перевірку статистичних гіпотез проводили на рівні значущості 0,05.
Результати дослідження та їх обговорення. На першому етапі дослідження проведено клініко-анамнестичне обстеження хворих на ЦД 2 типу за умов відносної (І група) та абсолютної (ІІ група) інсулінової недостатності. При вивченні анамнезу захворювання розглянуто стан вуглеводного обміну на момент постановки діагнозу. Виявлено, що у більшості обстежених хворих глікемія не перевищувала 11,0 ммоль/л (в середньому (9,65±0,2) ммоль/л). За таких умов не визначено залежності швидкості еволюції ЦД 2 типу від рівня виявленої на момент маніфестації захворювання глікемії. Таким чином, помірна виразність гіперглікемії (в межах (7,0-11,0) ммоль/л) під час постановки діагнозу ЦД має обмежену інформативність для передбачення швидкості формування у хворого абсолютної інсулінової недостатності. При аналізі особливостей попередньої терапії пацієнтів не визначено залежності між тривалістю періоду відносної інсулінової недостатності та видом пероральних цукрознижуючих препаратів, що були призначені хворим. Вивчення анамнезу обстежених пацієнтів виявило, що тривалість періоду від початку захворювання до моменту призначення інсулінотерапії або до моменту обстеження (у групі хворих з відносною інсуліновою недостатністю) не визначалася фактом дотримання хворими рекомендацій лікаря щодо дієтичного режиму та лікування. Тобто тривалість періоду відносної інсулінової недостатності не залежала від комплаєнтності хворих.
Як відомо, дисліпідемії майже завжди супроводжують ЦД, посилюючись за наявності надлишкової ваги. За результатами вивчення особливостей ліпідного обміну хворих на ЦД 2 типу, залежно від ступеня інсулінової недостатності, було побудовано факторні моделі, які виявили наявність в обох групах хворих дисліпідемій ІІ-а та ІV типу (ВООЗ). У ІІ групі також виділено присутність гіпоальфахолестеринемії, яка є самостійним чинником ризику атеросклерозу (Клімов А.М. і співавт., 1999). Для візуальної оцінки показників ліпідного спектру було побудовано діаграми частот виявлення відхилень показників ліпідного спектру від нормативних значень (Рис. 1).
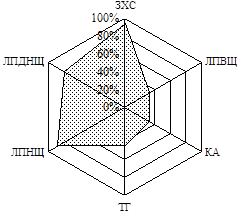
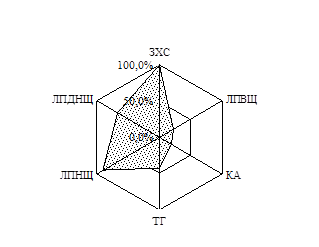
Рис. 1. Частота виявлення відхилень показників ліпідного спектру від нормативних значень у хворих І та ІІ груп
Слід зауважити, що хворі на ЦД 2 типу відрізнялись між собою за рівнем ЛПДНЩ (від нормальних до підвищених значень), при цьому він зростав зі збільшенням ваги. Коефіцієнт атерогенності змінювався, залежно від індексу маси тіла, лише у підгрупі хворих на ЦД 2 типу з нормальною вагою: у таких хворих значення КА зростало пропорційно збільшенню індексу маси тіла.
На підтвердження даних епідеміологічних досліджень про незалежний вплив гіперглікемії на ризик серцево-судинних катастроф у проведеній роботі виявлено кореляцію між рівнем глюкози крові натще та показниками атерогенних фракцій ліпідів (зокрема, ЗХС та ТГ). Указаний зв’язок в більшості випадків мав лінійний характер, збільшуючи ступінь атерогенності в міру збільшення глікемії. Незважаючи на відсутність розходжень у виразності діабетичної дисліпідемії за умов відносної та абсолютної інсулінової недостатності, у дослідженні виявлено суттєву залежність наявності в анамнезі судинних катастроф, а саме інфаркту міокарда, з наступним розвитком абсолютної інсулінової недостатності. Так хворі на ЦД 2 типу з розвинутою інсулінозалежністю більш ніж у чотири рази частіше, порівняно з хворими за умов відносної інсулінової недостатності (25,8 та 5,9% хворих відповідно, р=0,05), вказували на перенесений ними інфаркт міокарда. Це доводить украй важливе значення вивчення анамнезу пацієнтів, бо виявлення перенесених хворим гострих серцево-судинних станів свідчить на користь швидкого розвитку у нього абсолютної недостатності ендогенного інсуліну.
Стратегію подальшої терапії хворих на ЦД 2 типу багато в чому визначає рівень С-пептиду. При аналізі функціональних резервів підшлункової залози було виявлено зниження вмісту С-пептиду у хворих обох груп (0,43±0,06 нг/мл в І групі та 0,35±0,04 нг/мл у ІІ групі, р>0,05). Враховуючи відсутність достовірної різниці між середніми концентраціями С-пептиду у групах хворих з ефективною пероральною цукрознижуючою терапією та з інсулінотерапією, було проаналізовано стан компенсації вуглеводного обміну у пацієнтів обох груп. У хворих ІІ групи дана ситуація є закономірною, оскільки має місце абсолютна інсулінова недостатність. Виявлено, що, незважаючи на задовільні показники глікемії натще (6,3±0,24 ммоль/л), постпрандіальної (6,7±0,27 ммоль/л) та середньодобової глікемії (6,5±0,21 ммоль/л) у хворих І групи (тобто у хворих у стані ВІН), рівень глікозильованого гемоглобіну у них (7,7±0,26%) свідчить про відсутність компенсації вуглеводного обміну протягом попередніх трьох місяців. Останнє здатне викликати тимчасове зниження концентрації С-пептиду завдяки глюкозотоксичності. Для перевірки цього твердження 16 пацієнтам із низьким рівнем С-пептиду, випадково обраним із І групи, було призначено тимчасову інсулінотерапію (Рис. 2).
|
|
|
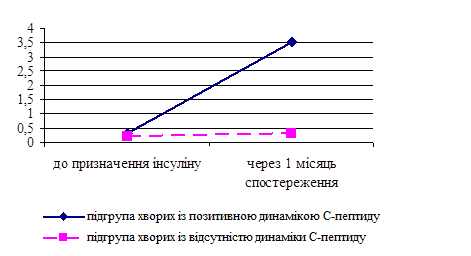
Рис. 2. Концентрація С-пептиду в динаміці спостереження у хворих І групи:
* - достовірність різниці між показниками в динаміці спостереження (р<0,001);
**- достовірність різниці між показниками в підгрупах хворих з позитивною динамікою та відсутністю динаміки С-пептиду через 1 місяць спостереження (р<0,001)
Після досягнення глікемічної компенсації через один місяць спостереження (глікемія натще (6,1±0,22) ммоль/л, постпрандіальна глікемія (6,5±0,25) ммоль/л, середньодобова глікемія (6,3±0,22) ммоль/л, добова аглюкозурія) концентрація С-пептиду у 13 хворих достовірно збільшилася (з 0,32±0,04 до (3,52±0,24) нг/мл, р<0,001) та сягала нормальних значень, в той час як у трьох хворих не спостерігалося динаміки С-пептиду (0,20±0,06 та (0,30±0,05) нг/мл, відповідно, р>0,05), що свідчить про абсолютну інсулінову недостатність. Вищеозначене дозволяє рекомендувати введення в клінічну практику методу тимчасової інсулінотерапії в якості тесту для диференціації станів відносного та абсолютного дефіциту інсуліну. Даний тест є інформативним у випадку виявлення зниженої концентрації С-пептиду на фоні декомпенсації вуглеводного обміну у хворих на ЦД 2 типу.
Попередні дослідження зарубіжних та вітчизняних учених стосувалися дерматогліфічних та молекулярно-генетичних маркерів, що визначають ступінь інсулінової недостатності за умов ЦД 2 типу. Водночас аналіз дерматогліфічного рисунку, на жаль, не здобув належного рівня поширеності, а молекулярно-генетичні дослідження є достатньо складними та багатовитратними, що обмежує їх застосування в рутинній медичній практиці. Серед простих методів, які можуть використовуватися будь-яким лікарем, на другому етапі дослідження було проведено аналіз родоводів хворих.
Структура спадкової обтяженості при ЦД 2 типу є типовою для захворювання з генетичним компонентом. Аналіз родоводів хворих на ЦД 2 типу показав, що частота виявлення хворих на дану патологію родичів в обстежених хворих вище, ніж поширеність захворювання в популяції, тобто має місце родинне накопичення ЦД 2 типу. Так відсоток уражених батьків серед родичів хворого в 5,5-9 разів вище, ніж у населенні в цілому (10,2% у І групі та 15,7% у ІІ групі, р<0,05). Родинне накопичення виявлено також у братів і сестер – 7,5% та 10,1% відповідно, що у 4–5,5 разів вище, ніж у популяції (р<0,05). Виявлено пряму залежність між розвитком абсолютної інсулінової недостатності у хворих на ЦД 2 типу та ступенем родинного накопичення цього захворювання у родичів першого та другого ступеня спорідненості: у хворих на ЦД 2 типу з абсолютною інсуліновою недостатністю у 4 рази була більшою кількість родичів другого ступеня спорідненості (дядьків та тіток), уражених на відповідну патологію, ніж у хворих на ЦД 2 типу з відносною інсуліновою недостатністю (р<0,001).
З метою визначення групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності було проведено аналіз, який довів наступне. Виявлення у пацієнта родичів, хворих на ЦД 2 типу, підвищує ймовірність швидкого розвитку в нього абсолютної інсулінової недостатності у 1,5 рази. При розподілі хворих за статтю виявлено більшу ймовірність розвитку інсулінозалежності у жінок, порівняно з чоловіками (1,6 та 1,1 разів відповідно).
Серед осіб, що виявилися спадково обтяженими, кількість хворих на ЦД родичів першого та другого ступеня спорідненості коливалася від 1 до 7 осіб. Враховуючи це, спадково обтяжених хворих також було розподілено на дві підгрупи, залежно від кількості хворих родичів. До 1 підгрупи ввійшли хворі, що мають одного ураженого родича першого чи другого ступеня, до другої підгрупи – ті, що мають 2 та більше хворих родичів (табл. 1). Хворі обох підгруп не відрізнялись за тривалістю ЦД, віком маніфестації захворювання, виразністю гіперглікемії при виявленні ЦД.
Таблиця 1
Характеристика спадково обтяжених хворих залежно від кількості уражених родичів
Стадія еволюції ЦД 2 типу |
Пробанди, що мають | |||
одного родича, хворого на ЦД 2 типу (n=50) |
двох табільшеродичів, хворих на ЦД 2 типу (n=47) | |||
| абс | % | абс | % | |
| Відносна інсулінова недостатність | 15 | 30,0 | 3 | 7,3 |
| Абсолютна інсулінова недостатність | 35 | 70,0 | 38 | 92,7 |
Таким чином, у підгрупі хворих, які мають двох та більше уражених родичів, відносна кількість хворих з більш несприятливим перебігом захворювання (раннім формуванням абсолютної інсулінової недостатності) суттєво перевищувала таку у хворих, що мають одного ураженого родича (р<0,05). При аналізі отриманих даних визначено, що відносний ризик розвитку абсолютної інсулінової недостатності (RR) у випадку, якщо хворий має двох та більшу кількість уражених родичів першого та/або другого ступеня, порівняно з одним ураженим, становить 5,4 (для жінок RR дорівнює 4,6, для чоловіків - 12,0). При збільшенні кількості уражених родичів ризик розвитку інсулінової залежності збільшується.
Узагальнюючи вищенаведені дані, до групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності можна віднести хворих на ЦД 2 типу, які мають уражених родичів. Імовірність швидкого розвитку абсолютної інсулінової недостатності значно збільшується в осіб, які мають двох та більше родичів першого та/або другого ступеня спорідненості, хворих на ЦД 2 типу. У зв’язку з цим у повсякденну лікарняну практику вкрай необхідно впровадити збір генеалогічного анамнезу, який може проводитись як генетиком, так і лікарем-ендокринологом чи терапевтом.
На третьому етапі роботи з метою з’ясування особливостей накопичення генів, асоційованих з ЦД 1 типу, за умов ЦД 2 типу на різних стадіях еволюції захворювання проведено молекулярно-генетичне дослідження, результати якого свідчать про частоту алеля Т гену тирозинфосфатази (PTPN22) серед хворих на ЦД 2 типу на рівні такої у хворих на ЦД 1 типу (табл. 2).
Таблиця 2
Частоти генотипів та алелей гену PTPN22 серед хворих на цукровий діабет 1 та 2 типу і здорових мешканців міста Харкова
| Показник | Контроль*, n=242 |
Хворі на ЦД 1 типу*, n=296 |
Хворі на ЦД 2 типу, n=52 |
Контроль - ЦД 1 типу |
Контроль - ЦД 2 типу | ||||||
| абс. | % | абс. | % | абс. | % | р | RR | р | RR | ||
| Генотип | С/С | 176 | 72,73 | 187 | 63,18 | 27 | 51,92 | <0,05 | 1,00 | <0,05 | 1,00 |
| С/Т | 64 | 26,45 | 93 | 31,42 | 22 | 42,31 | >0,05 | 1,37 | <0,05 | 2,24 | |
| Т/Т | 2 | 0,82 | 16 | 5,40 | 3 | 5,77 | <0,05 | 7,53 | <0,05 | 9,78 | |
| Алель | С | 416 | 85,95 | 467 | 78,89 | 76 | 73,08 | <0,05 | - | <0,05 | - |
| Т | 68 | 14,05 | 125 | 21,11 | 28 | 26,92 | <0,05 | - | <0,05 | - | |
Примітка. * – цитовано за М. Федець
Теоретично це може викликати у пацієнтів з ЦД 2 типу – носіїв цієї мутації – розвиток аутоімунної агресії проти інсулінпродукуючих клітин підшлункової залози. Проте дослідженням ІСА аутоімунний компонент розвитку абсолютної інсулінової недостатності не був доведений.
Молекулярно-генетичні дослідження показали захисне значення алелю С щодо розвитку ЦД. Навпаки, алель Т є фактором більш високого ризику розвитку захворювання. Людина з будь-яким варіантом генотипу (С/С, С/Т, Т/Т) може бути здоровою або може захворіти на ЦД. Проте ймовірність останнього не є однаковою: в осіб з генотипом С/С вона є зниженою, з генотипом С/Т – підвищеною. Найбільш високу ймовірність захворіти на ЦД мають гомозиготи Т/Т. Так у проведеному дослідженні доведено, що особи з генотипом Т/Т мають майже у 10 разів більш високий ризик захворіти на ЦД 2 типу, ніж особи, що не мають в генотипі алелю Т (гомозиготи С/С) (р<0,001).
Таким чином, у хворих на ЦД 2 типу визначено достовірно підвищену частоту відповідного поліморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), порівняно зі здоровими особами (в 1,9 разів). Подібна частота алелей С та Т гену PTPN22 у хворих на ЦД 2 типу за умов відносної та абсолютної інсулінової недостатності у поєднанні з невеликою частотою виявлення та низьким титром ІСА засвідчує несуттєвий внесок аутоімунних механізмів у спонтанну еволюцію захворювання. Наявність алеля Т у хворих на ЦД 2 типу може свідчити про те, що він є маркером, за яким можна формувати групу ризику щодо розвитку цього захворювання серед осіб з метаболічним синдромом без порушення толерантності до глюкози (RR=9,78).
Опубліковані алгоритми лікування хворих на ЦД 2 типу (AmericanDiabetesAssociationandtheEuropeanAssociationfortheStudyofDiabetes, 2006), на жаль, не припинили дискусій щодо інсулінотерапії як медикаментозного лікування першої лінії при неефективності монотерапії метформіном на фоні зміни способу життя (StandlE. etal., 2008). Адже відомо, що рання інсулінотерапія дозволяє подовжити період залишкового функціонування панкреатичних β-клітин (RyanE.A. etal.,2004;IlkovaH. etal., 1997). Проте упередженість хворих щодо призначення інсуліну не дає змоги лікарям використовувати комбіновану терапію на перших кроках лікування. Останнім викликана необхідність визначення групи хворих, для яких раннє призначення базальної інсулінотерапії є необхідним.
Проведеним дослідженням доведено наявність груп ризику щодо раннього розвитку абсолютної інсулінової недостатності. Хворим зі спадковою обтяженістю на ЦД 2 типу (тим, що мають двох та більше родичів першого та/або другого ступенів спорідненості, хворих на ЦД 2 типу) та пацієнтам, які мають в анамнезі серцево-судинні катастрофи, а саме, інфаркт міокарда, доцільно починати інсулінотерапію (спочатку в комбінації з пероральними цукрознижуючими препаратами) на етапі неефективного контролю вуглеводного обміну за допомогою зміни способу життя та монотерапії метформіном.
ВИСНОВКИ
1. У дисертації визначено фактори ризику раннього розвитку абсолютної інсулінової недостатності у хворих на цукровий діабет 2 типу, обґрунтовано призначення ранньої інсулінотерапії хворим групи ризику, запропоновано метод диференціації станів відносної та абсолютної інсулінової недостатності за наявності зниженої концентрації С-пептиду.
2. Доказано доцільність урахування наявності інфаркту міокарда в анамнезі як предиктора раннього розвитку абсолютної інсулінової недостатності у хворих на цукровий діабет 2 типу, незалежно від виразності діабетичної дисліпідемії.
3. Наявність сімейного накопичення цукрового діабету 2 типу визначає більший ризик розвитку у хворого абсолютної недостатності інсуліну (RR=1,5). До групи найвищого ризику належать пацієнти, які мають двох та більше родичів першого та/або другого ступенів спорідненості, хворих на цукровий діабет 2 типу (RR=5,4).
4. Установлено достовірно підвищену частотуполіморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), що відіграє роль в аутоімунному пошкодженні β-клітин підшлункової залози, у хворих на цукровий діабет 2 типу, порівняно зі здоровими особами (в 1,9 разів). Водночас подібна частота алеля Т гену PTPN22 у хворих на цукровий діабет 2 типу за умов відносної та абсолютної інсулінової недостатності в поєднанні з невеликою частотою виявлення антитіл до острівцевих клітин підшлункової залози та їх низьким титром свідчить про несуттєвий внесок аутоімунних механізмів в еволюцію захворювання.
5. Доведено обмежену інформативність помірної гіперглікемії на момент маніфестації цукрового діабету (в межах 7-11 ммоль/л) для визначення швидкості формування у хворого абсолютної інсулінової недостатності.
6. Визначено зниження концентрації С-пептиду у хворих на цукровий діабет 2 типу як за наявності абсолютної інсулінової недостатності, так і на стадії відносної інсулінової недостатності. Тимчасове призначення інсулінотерапії дозволяє за характером динаміки рівня С-пептиду диференціювати стани відносного та абсолютного дефіциту інсуліну для подальшого призначення адекватного лікування (комбінована пероральна або інсулінотерапія).
7. Для гальмування спонтанної еволюції захворювання обґрунтовано доцільність призначення інсулінотерапії на етапі неефективності лікування метформіном хворим із групи підвищеного ризику формування абсолютної інсулінової недостатності (за наявності двох та більше хворих на цукровий діабет 2 типу родичів та/або інфаркту міокарда в анамнезі).
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Для визначення групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності з метою своєчасного призначення інсулінотерапії лікарям практичної охорони здоров’я рекомендується в разі встановлення діагнозу «цукровий діабет 2 типу» провести аналіз стану здоров’я родичів хворого (першого та другого ступеня спорідненості) на предмет наявності у них цукрового діабету.
2. У пацієнтів групи ризику (за наявності двох та більше хворих на цукровий діабет 2 типу родичів та/або інфаркту міокарда в анамнезі) у випадках неможливості досягнення компенсації цукрового діабету (рівень HbA1c≥ 7%) шляхом модифікації способу життя та застосування метформіну необхідно додаткове призначення базальної інсулінотерапії.
3. Для вирішення питання про необхідність початку своєчасної інсулінотерапії (розвиток абсолютної інсулінової недостатності) хворим на цукровий діабет 2 типу у випадку встановлення концентрації С-пептиду < 0,5 нг/мл на фоні пероральної цукрознижуючої терапії показано тимчасове
8-09-2015, 22:38
