Таблиця 2
Клінічна характеристика дітей із ІІ групи
| Симптоми | Новонароджені, n=31 | Діти у віці 1-2 міс, n=31 | ||
| n | % | n | % | |
| Шум під час аускультації серця | 31 | 100 | 23 | 74,2 |
| Періоральний і акроціаноз | 27 | 87,1 | - | - |
| Тотальний ціаноз | 4 | 12,9 | 29 | 93,6 |
| Тахікардія | 17 | 54,8 | 6 | 19,4 |
| Задишка | 9 | 29 | 6 | 19,4 |
| Втома під час годування | - | - | 8 | 25,8 |
| Гіпотрофія І ступеня | - | - | 7 | 22,6 |
| М`язова гіпотонія, млявість | 4 | 12,9 | - | - |
легеневого рисунку в середній частці легеневих полів, що свідчило про виражений бронхіальний компонент кровоплину. У половини (54,8 %) немовлят серце було невеликих розмірів і типової форми у вигляді «черевичка». За допомогою ДЕхоКГ у 16,1 % пацієнтів вдалось візуалізувати колатеральний аорто-легеневий кровоплин.
Відомо, що постнатальна динаміка структурних змін, що визначають ПВС, може залежати від певних особливостей метаболізму основних маркерів ДЕ – NO і ЕТ-1. У новонароджених з ПВС кількість NO2 - у сироватці крові втричі перевищувала показники контрольної групи і становила 1,727±0,063 мкмоль/л проти 0,522±0,04 мкмоль/л (р<0,001). Водночас, концентрація ЕТ-1 у сироватці крові новонароджених з ПВС була суттєво нижчою від значень контрольної групи: 0,066±0,003 фмоль/мл проти 0,24±0,007 фмоль/мл (р<0,0001). Ми не виявили достовірної відмінності між рівнем цих маркерів ДЕ у сироватці крові новонароджених з ПВС залежно від статевої ознаки, важкості стану, типу ПВС та наявності синдрому Дауна (табл. 3).
У дітей з ПВС, які характеризуються збагаченням малого кола кровообігу, одним зі стимулів, що може спричинювати «гормональну» реакцію ендотеліоцитів, є зміна швидкості кровотоку, що вимагає підсиленого синтезу вазодилятатора NO і мінімальної секреції ЕТ–1. Це дає можливість максимально розширити легеневе русло і прийняти надмірний об’єм крові, спрямований до легень. Крім того, відмічено, що дія ЕТ–1 визначається його концентрацією. У низьких концентраціях він може викликати вазодилятацію, тоді як у високих – значну і тривалу вазоконстрикцію (В.Серкова, Н.Горобец, 2005).
Таблиця 3
Концентрація маркерів дисфункції ендотелію в сироватці крові новонароджених з ПВС, (M±m)
| Маркери ДЕ | Групи обстежених | Всі діти n=130 |
Хлопці n=56 |
Дівчата n=74 |
Синдром Дауна n=23 |
Загальний стан | ||
| середньої важкості n=53 | важкий n=25 |
дуже важкий n=17 |
||||||
NO2 - мкмоль/л |
І група n=64 |
1,75± 0,058* |
1,679± 0,091* |
1,809± 0,073* |
1,82± 0,116* |
1,734± 0,102* |
1,745± 0,081* |
1,783± 0,114* |
ІІ група n=31 |
1,703± 0,069* |
1,717± 0,112* |
1,695± 0,089* |
2,0± 0,4* |
1,601± 0,248* |
1,612± 0,12* |
1,95± 0,185* |
|
ПВС n=95 |
1,727± 0,063* |
1,698± 0,102* |
1,752± 0,081* |
1,91± 0,258* |
1,688± 0,063* |
1,614± 0,714* |
1,867± 0,149* |
|
Контрольна група n=35 |
0,523± 0,04 |
0,524± 0,058 |
0,522± 0,058 |
- | - | - | - | |
ЕТ-1 фмоль/мл |
І група n=64 |
0,068± 0,002* |
0,07± 0,004* |
0,067± 0,002* |
0,063± 0,004* |
0,072± 0,001* |
0,069± 0,005* |
0,065± 0,005* |
ІІ група n=31 |
0,065± 0,004* |
0,063± 0,007* |
0,066± 0,006* |
0,05± 0,001* |
0,057± 0,006* |
0,745± 0,004* |
1,013± 0,014* |
|
ПВС n=95 |
0,066± 0,003* |
0,066± 0,005* |
0,066± 0,004* |
0,056± 0,002* |
0,066± 0,003* |
0,067± 0,004* |
0,067± 0,005* |
|
Контрольна група n=35 |
0,24± 0,007 |
0,238± 0,038 |
0,242± 0,009 |
- | - | - | - | |
Примітка:
* - відмінність вірогідна порівняно з групою здорових дітей (р<0,05)
Нами встановлено, що концентрація NO2 - понад 1,0 мкмоль/л та ЕТ–1 нижче 0,2 фмоль/мл можуть бути додатковою диференційною ознакою ПВС у новонароджених.
У пацієнтів з ПВС, що характеризувалися зменшеним легеневим кровообігом із–за стенозу, гіпоплазії чи атрезії легеневої артерії, при народженні до легень надходить відносно достатня кількість крові, яка відповідає об’єму судинного русла, оскільки функціонують фетальні комунікації, зокрема артеріальна протока. Але ця кількість крові є недостатньою для адекватної оксигенації організму. Імовірно, що це вимагає вазодилятації судин малого кола кровообігу, з чим може і бути пов’язаний підвищений рівень NO2 - і невелика кількість ЕТ–1 у сироватці крові таких новонароджених.
Таким чином, вазодилятатор NO і вазоконстриктор ЕТ–1 є маркерами ДЕ при ПВС у дітей. Можна думати, що завдяки вазодилятації легеневих судин, яка виникає за рахунок дії як великої кількості синтезованого NO, так і за рахунок стимуляції вазодилятації незначною кількістю ЕТ–1, організм новонародженої дитини починає адаптуватися до життя в умовах гіпоксії.
Уважається, що після місячного віку в дітей минає фізіологічна ЛГ. У немовлят з ПВС і надмірним легеневим кровообігом домінуючою в клінічному перебігу вади залишається вторинна ЛГ, що веде до формування ДЕ і перебудови судинного русла легень. Визначення основних маркерів ДЕ в цьому віці дозволило нам уявити стан метаболічних перетворень в ендотелії судинного русла й одержати певну інформацію стосовно глибини порушень синтезу NO2 - і ЕТ–1. У немовлят контрольної групи спостерігалось підвищення рівня NO2 - у сироватці крові втричі з середнім показником 1,631 ± 0,064 мкмоль/л (р<0,0001). Рівень ЕТ–1 у здорових немовлят зростав удвічі і становив 0,571 ± 0,013 фмоль/мл (р<0,0001). У сироватці крові немовлят з ПВС, що характеризувались збагаченим легеневим кровообігом, концентрація NO2 - з віком залишалась незмінною, 1,747 ± 0,057 мкмоль/л, і фактично зрівнювалась з показниками контрольної групи у віці одного–двох місяців (р=0,179), тоді як концентрація ЕТ–1 стрімко зростала до 1,428 ± 0,034 фмоль/мл (р<0,001), достовірно перевищуючи показники контрольної групи (рис. 1).
Очевидно, об’єм крові, швидкість, з якою вона циркулює в малому колі кровообігу і, відповідно, тиск у системі легеневої артерії зростають максимально і досягають певного критичного рівня. Регуляція судинного тонусу у легенях, за таких умов, здійснюється за рахунок компенсаторних можливостей організму, що виявляється сповільненням синтезу NO і стимуляцією продукції ЕТ–1. Це забезпечує вазоконстрикцію і зменшення площі судинного русла легень. Внаслідок проліферативних процесів зменшується діаметр судин, збільшується співвідношення товщини стінки і просвіту судин, підвищується їх резистентність. До певного часу NO в стані адекватно підтримувати рівень кровотоку. Якщо ж індукція NO буде продовжуватись, настане параліч капілярних сфінктерів, коли вазорелаксуюча дія NO досягне токсичного характеру. Окрім цього, якщо на кардіоміоцити діє невелика кількість NO, збільшується сила їх скорочення, а високі концентрації NO пригнічують функцію міокарда. Комплексна взаємодія між вазоактивними субстанціями, які продукує ендотелій, визначає зміни судинного легеневого тонусу.
Нами було проаналізовано динаміку рівня NO2 - у сироватці крові немовлят із І групи з діагностованою ЛГ ІІ ступеня важкості. У 54 (84,4 %) таких дітей рівень NO2 - у сироватці крові з віком знижувався, залишався незмінним, або ж зростав не більше, як на 22 % від початкового рівня, а гемодинаміка характеризувалась значним ліво–правим скидом крові.
Якщо взяти до уваги, що у дітей контрольної групи концентрація NO2 - у сироватці крові з віком зростала і це сприяло ліквідації фізіологічної ЛГ, то зниження кількості NO2 - чи відсутність будь-якої динаміки може свідчити про ймовірне ушкодження ендотелію судинної стінки і виснаження механізмів, спрямованих на ліквідацію ЛГ у разі надмірного надходження крові до легень. У решти 10 (15,6 %) дітей І групи відбувалось достовірне підвищення концентрації NO2 - в динаміці з 1,26 ± 0,097 мкмоль/л до 1,73 ± 0,124 мкмоль/л (р<0,05), і у всіх цих пацієнтів ехокардіографічно було діагностовано ЛГ І ступеня. Таким чином, 84,4 % пацієнтів одно–двомісячного віку з ПВС, що характеризуються збагаченим легеневим кровообігом, створили групу ризику швидкого прогресування ЛГ і раннього виникнення незворотних структурних змін у системі легеневої артерії. Можна стверджувати, що ці пацієнти вимагають негайного хірургічного лікування, яке обмежить надходження крові до легень, чи радикальної корекції ПВС незалежно від віку дитини.
Діти з ПВС і надмірним легеневим кровообігом вимагали терапії застійної НК. Додатково з метою відтермінування ЛГ та зменшення дилятації камер серця частина немовлят одержували інгібітори АПФ, а частина – блокатори рецепторів до ангіотензину І. Визначені у сироватці крові концентрації NO2 - і ЕТ–1 не відрізнялись залежно від призначення медикаментів. Однак, у групі немовлят, які отримували лозартан, нами відмічена тенденція до скорішої стабілізації серцевої діяльності (рис. 2).
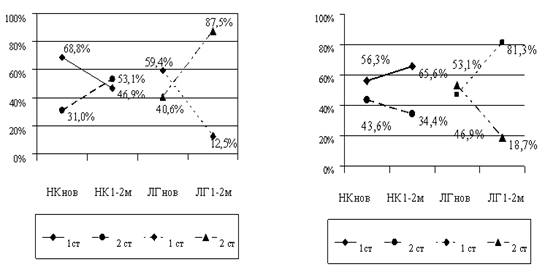
Лікування з використанням каптоприлу Лікування з використанням лозартану
Рис. 2. Зміни ступеня недостатності кровообігу і легеневої гіпертензії у дітей І групи залежно від призначеного лікування.
На фоні терапії лозартаном у 23 (71,9 %) пацієнтів гемодинаміка залишалась стабільною і ще у 6 (18,8 %) спостерігалось клінічне покращення. Загалом клінічний ефект ми отримали у 29 (90,6 %) дітей, в комплекс лікування яких був включений лозартан, і у 23 (71,9 %) немовлят, які лікувались каптоприлом (р<005). Таким чином, терапія лозартаном виявилась клінічно ефективнішою порівняно з лікуванням каптоприлом. Однак, суттєвої відмінності у здатності цих медикаментів запобігти прогресуванню ЛГ нами не було виявлено. Швидша стабілізація клінічного стану у пацієнтів з ПВС, для яких є характерним збагачений легеневий кровообіг, внаслідок використання лише одного прийому на добу блокаторів рецепторів до ангіотензину І обґрунтовують необхідність застосування останніх в лікуванні ЛГ.
Для уточнення функціонального стану ендотелію у дітей з ПВС, що характеризуються збідненим легеневим кровообігом, також вивчали динаміку NO2 - й ЕТ–1 у сироватці крові. Отримані нами результати дають підстави по – новому подивитись на значення змін вмісту маркерів ДЕ в сироватці крові у даної групи пацієнтів. В цьому випадку поряд з незначним (порівняно з показниками немовлят із I групи) ростом ЕТ–1 до 0,194 ± 0,012 фмоль/мл, спостерігалось зниження концентрації NO2 - до 0,53 ± 0,04 мкмоль/л. Причому, кількість ЕТ–1 у крові дітей ІІ групи у віці одного–двох місяців, була втричі меншою (р<0,001) від значення цього маркера ДЕ в немовлят контрольної групи (рис. 1).
За умови обмеженого надходження крові до малого кола кровообігу, що зумовлено стенозом чи гіпоплазією легеневих судин, маємо недостатній для адекватної оксигенації організму об’єм крові, ймовірно, тому ДЕ характеризується зниженням синтезу NO2 - . Можливо, в даній ситуації, не включаються вазоконстрикторні механізми, тому синтез ЕТ-1 є сповільненим. Крім того, існують дослідження, результати яких вказують на те, що дія ЕТ–1 певною мірою визначається його концентрацією, і в низьких концентраціях він може спричинювати вазодилятацію. Впливаючи на ендотеліальні рецептори, ЕТ–1 стимулює продукцію NO. Оскільки стінка венозних судин більш чутлива до ЕТ–1, вазоконстрикторний ефект спочатку виявляється у венах, а потім, зі збільшенням концентрації ЕТ–1 у сироватці крові, в артеріальних судинах. Тому не дивно, що у дітей з ПВС і обмеженим легеневим кровообігом ми отримали повільне зростання ЕТ–1. Виходячи з цього, можна припустити, що зменшений просвіт легеневих вен призведе до сповільненого відтоку крові з малого кола кровообігу. Таким способом відбувається максимальна затримка крові в малому колі кровообігу і забезпечується максимально можливий газообмін.
Не виключено, що зниження синтезу ЕТ–1 у дітей з гіпоплазією чи стенозом легеневих судин пов’язано з дефектами самого ендотеліального шару і порушеною продукцією ЕТ–1 ендотеліоцитами. Причому, у разі ушкодження ендотелію вазоконстрикцію можуть спричинювати менші дози ЕТ–1.
Нами встановлено, що зміни концентрації NO2 - та ЕТ–1 залежать від типу ПВС, зумовленого збагаченим чи збідненим легеневим кровообігом, а також тривалості захворювання, і не залежать від ступеня важкості НК, статевої ознаки та наявності синдрому Дауна.
Ми сподіваємось, що висвітлені зміни маркерів ДЕ при ПВС поглиблять розуміння патогенетичних механізмів розвитку ЛГ. Це також сприятиме швидшій і достовірнішій діагностиці ЛГ у немовлят з ПВС, які характеризуються збагаченим легеневим кровообігом. Диференційоване застосування блокаторів рецепторів до ангіотензину І або інгібіторів АПФ дозволить сповільнити розвиток ЛГ, підвищити якість життя немовлят з ПВС цього типу, відтермінувати важкі проліферативні зміни у легеневих судинах, що дасть можливість одержати найкращі результати кардіохірургічної корекції.
ВИСНОВКИ
У дисертації наведено теоретичне узагальнення і нове вирішення актуальної наукової задачі, що полягає у підвищенні ефективності надання медичної допомоги немовлятам з природженими вадами серця шляхом розробки критеріїв ранньої діагностики і прогнозування перебігу легеневої гіпертензії, а також оптимізації лікування на підставі дослідження маркерів дисфункції ендотелію.
1. У здорових дітей протягом першого місяця життя спостерігається значне зростання рівня нітрит аніону та помірне підвищення вмісту ендотеліну–1 у сироватці крові, що сприяє становленню фізіологічного системного і легеневого кровоплину.
2. Для новонароджених з природженими вадами серця характерна висока концентрація нітрит аніону та знижений рівень ендотеліну–1 в сироватці крові у ранньому неонатальному періоді. Динаміка вмісту основних маркерів дисфункції ендотелію, нітрит аніону й ендотеліну–1, у сироватці крові не залежить від ступеня важкості недостатності кровообігу, статі та супутньої генетичної патології (синдром Дауна).
3. У дітей з природженими вадами серця, що характеризуються збагаченим легеневим кровообігом, протягом першого місяця життя рівень нітрит аніону у сироватці крові не змінюється, а концентрація ендотеліну–1 значно зростає, що може бути обумовлено перевантаженням малого кола кровообігу надмірним об’ємом крові. Досягнення оптимального тонусу судинної стінки у системі легеневої артерії відбувається за рахунок сповільненого синтезу вазодилятаторів та активації утворення речовин з вазоконстрикторним ефектом.
4. У дітей з природженими вадами серця, які характеризуються збідненим легеневим кровообігом, протягом першого місяця життя рівень нітрит аніону у сироватці крові знижується, а кількість ендотеліну–1 незначно зростає. Концентрація цих маркерів функціональної активності ендотелію в одно–двомісячному віці є суттєво нижчою від їх рівня у здорових дітей.
5. Відсутність значного зростання концентрації нітрит аніону (не більше, ніж на 22 % від величини, визначеної в перші чотири дні життя) у сироватці крові дітей з природженими вадами серця, які характеризуються збагаченим легеневим кровообігом, свідчить про вірогідно вищий ризик швидкого прогресування легеневої гіпертензії.
6. Використання у комплексному лікуванні немовлят з вторинною легеневою гіпертензією блокатору рецепторів до ангіотензину І (лозартану) порівняно із застосуванням інгібітору ангіотензинперетворюючого ферменту (каптоприлу) забезпечує досягнення кращих клінічних результатів, сповільнюючи розвиток недостатності кровообігу і створюючи можливість для своєчасної оперативної корекції вади серця.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Доцільно впровадити у практику роботи спеціалізованих неонатологічних відділень визначення концентрації нітрит аніону та ендотеліну–1 у сироватці крові новонароджених з клінічними ознаками природжених вад серця. Рівень нітрит аніону понад 1,0 мкмоль/л та концентрація ендотеліну–1 менше 0,2 фмоль/мл, є додатковою диференційною ознакою природжених вад серця у новонароджених.
2. Включити в комплекс обстеження дітей з природженими вадами серця, що характеризуються збагаченим легеневим кровообігом, дослідження концентрації нітрит аніону у сироватці крові в динаміці (що місяця), що дасть можливість прогнозувати характер перебігу легеневої гіпертензії. Пацієнтів з незначним збільшенням цього показника (не більше, ніж на 22 % від його величини в періоді новонародженості) відносити до групи ризику швидкого прогресування легеневої гіпертензії.
3. Дітям зі встановленим діагнозом природженої вади серця, яка характеризується збагаченим легеневим кровообігом, з метою скорішої стабілізації гемодинаміки, скорочення передопераційного періоду та зменшення тривалості перебування пацієнта у стаціонарі доцільно призначати лозартан у добовій дозі 0,5 мг/кг. Використання цього препарату лише один раз у добу є більш зручним для батьків пацієнтів з природженими вадами серця.
СПИСОК РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Гнатейко О.З. Зміна рівня метаболітів оксиду азоту в сироватці крові при природжених вадах серця у новонароджених дітей / О.З. Гнатейко, О.Я. Скляров, І.Ю. Авраменко // Педіатрія акушерство гінекологія. – 2006. - № 4. – С. 11-13 (дисертантом особисто проведено пошук та проаналізовано літературні джерела по даній темі, проведена обробка отриманих результатів та їх оцінка, підготовано матеріал до друку).
2. Авраменко І.Ю. Значення оксиду азоту як маркера дисфункції ендотелію при вроджених вадах серця у дітей раннього віку / І.Ю. Авраменко // Проблеми медичної науки та освіти. – 2006. - № 3. –С. 86-88.
3. Гнатейко О.З. Зміна рівня маркерів дисфункції ендотелію в сироватці крові новонароджених із вродженими вадами сеця / О.З. Гнатейко, І.Ю. Кулачковська, І.Ю. Авраменко // Перинатология и Педиатрия. – 2007. – № 29. – С. 11-13 (дисертантом особисто проведено дослідження, обробка отриманих результатів та їх оцінка, підготовано матеріал до друку).
4. Авраменко І.Ю. Роль ендотеліну-1 як маркера дисфункції ендотелію при вроджених вадах серця у дітей раннього віку / І.Ю. Авраменко // Одеський медичний журнал. – 2007. – Т. 3, № 101. – С. 38 – 41.
5. Авраменко І.Ю. Роль дисфункції ендотелію при вроджених вадах серця у дітей раннього віку / І.Ю. Авраменко // Вісник Сумського державного університету. – 2007. – № 2. – С. 67 – 71.
6. Короляк О.Я. Роль сироваткових метаболітів оксиду азоту в новонароджених з вродженими вадами серця. – V (ювілейна) всеукраїнська науково-практична конференція «Актуальні питання дитячої кардіоревматології», 27-28 квітня 2006 р. : Матеріали / О.Я. Короляк, Р.Я. Ковальський, І.Ю. Авраменко // Таврический медико-биологический вестник. – 2006. – Т. 9, № 2. – С. 113 (дисертантом особисто проведено пошук та проаналізовано літературні джерела по даній темі, проведена обробка отриманих результатів та їх оцінка, підготовано матеріал до друку).
7. Гнатейко О.З. Оксид азоту як маркер дисфункції ендотелію при природжених вадах серця у дітей. – ІІІ конгрес педіатрів України «Сучасні проблеми клінічної педіатрії» м. Київ, 17-19 жовтня / О.З. Гнатейко, І.Ю. Авраменко, Л.М. Куновська // Матеріали ІІІ конгресу педіатрів України. – Київ. – 2006. – С. 23 – 24 (дисертантом особисто проведено дослідження, обробка отриманих результатів та їх оцінка, підготовано матеріал до друку).
8. Авраменко І.Ю. Концентрація маркерів дисфункції ендотелію в сироватці крові новонароджених з вродженими вадами серця. – VІ всеукраїнська науково-практична конференція «Актуальні питання дитячої кардіоревматології», 26-28 квітня 2007 р.: Матеріали / І.Ю. Авраменко, Р.Я. Ковальський, М.В. Децик // Таврический медико-биологический вестник. – 2007. – Т. 19, № 2. – С.105 (дисертантом особисто проведено дослідження, обробка отриманих результатів та їх оцінка, підготовано матеріал до друку).
9. Gnateiko O. Increasing nitric oxide levels of the blood of the children diseased with congenital heart conditions / O. Gnateiko, O. Sklyarov, I. Kulachkovs’ka, I.Avramenko // Annales Universitatis Mariae Curie – Sklodowska. Sectio
8-09-2015, 22:59
