Міністерство охорони здоров’я України
Тернопільський державний медичний університет
імені І.Я. Горбачевського
ГАЙДУЧОК ІГОР ГРИГОРОВИЧ
УДК 616-092.19-008.61:(612.13/.16-018.74+616.155.33)
ВЗАЄМОЗВ’ЯЗКИ ХЛАМІДІЙНОЇ ІНФЕКЦІЇ
ТА ІМУНОДЕФІЦИТУ: ІМУНОПАТОГЕНЕЗ
ТА ІМУНОДІАГНОСТИКА
14.03.04 – патологічна фізіологія
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Тернопіль–2008
Дисертацією є рукопис.
Робота виконана у Львівському національному медичному університеті імені Данила Галицького МОЗ України
Науковий керівник: доктор медичних наук, професор Чоп’як Валентина Володимирівна,
Львівський національний медичний університет імені Данила Галицького МОЗ України, завідувач кафедри клінічної імунології та алергології
Офіційні опоненти:
доктор медичних наук, професор Мисула Ігор Романович, Тернопільський державний медичний університет імені І. Я. Горбачевського, завідувач кафедри медичної реабілітації та спортивної медицини
доктор медичних наук Нещерет Олександр Павлович, Інститут ендокринології та обміну речовин ім. В.П. Комісаренка АМН України, провідний науковий співробітник лабораторії епідеміології і цукрового діабету
Захист відбудеться 17 січня 2008 р. о 14 годині на засіданні спеціалізованої вченої ради Д 58.601.01 у Тернопільському державному медичному університеті імені І. Я. Горбачевського МОЗ України (46001, м. Тернопіль, Майдан Волі, 1)
З дисертацією можна ознайомитись у бібліотеці Тернопільського державного медичного університету імені І. Я. Горбачевського МОЗ України (46001, м. Тернопіль, вул. Січових Стрільців, 8)
Автореферат розісланий 16 грудня 2007 р.
Вчений секретар спеціалізованої вченої ради
доктор медичних наук, професор Я.Я. Боднар
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Патогенез хронічної хламідійної інфекції дотепер є предметом різнобічного вивчення (Мавров Г.І., 2006, Tejde, 2004). Механізми, які сприяють хронічній персистенції хламідійної інфекції, тісно пов’язані з формуванням порушеного природного та набутого імунного нагляду над нею (Дранник Г.М., 2006). Особливо небезпечна хронічна хламідійна інфекція з частими реактиваціями, які можуть зумовлювати розвиток постхламідійних ускладнень – урогенітальних, офтальмологічних, суглобових, респіраторних, кардіологічних, неврологічних тощо (Дріянська В.Е., 2004; Ward M. 2006 ).
Активацію цієї інфекції, а особливо формування її ускладнень, супроводжує гіперімунокомплексний синдром, вивчення якого залишається актуальним питання в патофізіології (Holland S et al. 2001). Відомо, що гіперімунокомплексний синдром є провідною ланкою ряду інфекційних захворювань, а також автоімунних, пухлинних тощо (Чоп’як В.В., 1998). Механізми розвитку цього синдрому звикли трактувати як гіперсенситивний прояв імунної відповіді, але останніми роками він оцінюється як ознака імунної недостатності, яка пов’язана з послабленням функцій системи фагоцитів (Лєбєдєв К.А., 2003). Цей синдром може супроводжуватись також продукцією структурно-неповноцінних антитіл, зниженою активністю “осліплених” імунними комплексами лімфоцитів. При тривалій персистенції хламідій спостерігається розвиток хронічного гіперімунокомплексного синдрому, а також автоімунних ускладнень цієї інфекції, пов’язаних із формуванням хвороби Рейтера, вторинних постхламідійних системних васкулітів, увеїтів, набутих неревматичних вад серця, бронхіальної астми тощо (Hunter Y.,1998).
Відомо, що потужним резервуаром хламідій в організмі є циркулюючі та фіксовані фагоцити. Активність цих клітин тісно пов'язана з формуванням гіперімунокомплексемії (Гомберг М.А.,2001). Недостатньо вивченим є метаболізм оксиду азоту – імуноопосередкованого вазоактивного фактору, який значною мірою продукуються фагоцитами (Сосунов А. А., 2000). Він може визначати предикторні фактори перебудови природної і адаптивної імунної відповіді та впливати на розвиток імунодефіцитних проявів, а також автоімунних запальних ускладнень (Нещерет О.П., 2006, Mantovani B., 2003). Зміни обміну L-аргініну в фагоцитах, особливо його NO-синтазного шляху активації, можуть зумовлювати зниження захисних механізмів організму (Кitamoto S. et al., 2005) з розвитком метаболічно-імунної дизадаптації (Мисула І.Р., 2005)
У зв’язку з тим виникає необхідність глибшого розуміння патогенезу хронічної хламідійної інфекції з синдромом гіперімунокомплексемії, перебудови імунної відповіді в хворих на хламідіоз з проявами імунодефіциту та автоімунними ускладненнями (Михайленко О. О., Покровський В. І., 2002). Такий напрямок досліджень надалі може створити перспективу та дозволити впливати на зменшення кількості неплідних шлюбів, спричинених хламідійною інфекцією, суглобових та офтальмологічних ускладнень із розвитком швидкої інвалідизації молодих людей, формування в них раннього атеросклерозу, хронічних обструктивних захворювань легень, активізацію розробок патогенетичних методів лікування та профілактики хвороб, зумовлених хламідійною інфекцією (Каграмонова Ж.А., 2005).
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є фрагментом планової міжкафедральної науково-дослідної роботи на тему “Імуно-ендотеліально-епітеліальнозалежні механізми в розвитку гіперімунокомплексного синдрому в експерименті і клініці”, яка виконувалась на кафедрах клінічної імунології та алергології, патологічної фізіології та ендоскопії і малоінвазивної хірургії Львівського національного медичного університету імені Данила Галицького (№ держреєстрації 0101U009233). У виконанні цієї роботи дисертант приймав участь у моделюванні хронічного гіперімунокомплексного синдрому та виявленні хворих на хламідіоз із супутнім гіперімунокомплексним синдромом та проявами імунодефіциту. Тема дисертаційної роботи затверджена проблемною комісією МОЗ та АМН України “Клінічна імунологія та алергологія” 20 квітня 2004 р. ( протокол №3 ).
Мета дослідження. Встановити особливості функціонально-структурних змін фагоцитів за умов гіперімунокомплексного синдрому в експерименті та його роль в розвитку хронічної хламідійної інфекції в хворих з проявами імунодефіциту.
Завдання дослідження:
1. Оцінити фагоцитарну, окисно-відновну, NО-залежну активність фагоцитів крові щурів за умов хронічного гіперімунокомплексного синдрому.
2. Охарактеризувати електронно-мікроскопічні особливості змін фагоцитів крові та ендотеліоцитів аорти щурів за умов хронічної гіперімунокомплексного синдрому.
3. Виявити особливості стану фагоцитарної ланки імунної системи хворих на хламідійну інфекцію з гіперімунокомплексним синдромом та за умов імунодефіцитних проявів.
4. Проаналізувати адаптивну імунну відповідь – лімфоцитарну та антитілозалежну в хворих на хламідіоз, а також у поєднанні з гіперімунокомплексним синдромом та імунодефіцитом.
5. Оцінити цитокіновий регуляторний баланс у хворих на хламідійну інфекцію з супутнім гіперімунокомплексним синдромом та проявами імунодефіциту.
6. Охарактеризувати імунологічні маркери імунодефіциту та автоімунних ускладнень у хворих на хламідійну інфекцію.
Об’єкт дослідження – хронічний гіперімунокомплексний синдром та хронічна хламідійна інфекція із супутнім гіперімунокомплексним синдромом та проявами імунодефіциту.
Предмет дослідження – показники захоплювальної, окисно-відновної, NО-залежної активності фагоцитів крові, їх ультраструктура в контрольних та дослідних тварин за умов експериментального хронічного гіперімунокомплексного синдрому, а також показники поглинальної та ферментативної активності циркулюючих мікро- та макрофагоцитів, популяцій та субпопуляцій лімфоцитів, їх функціональної активності, специфічної антитілопродукції, регуляторних цитокінів та маркерів хламідійної інфекції в хворих на хламідіоз.
Методи дослідження: з метою вивчення особливостей функціонально-структурних змін фагоцитів за умов гіперімунокомплексного синдрому в експерименті та їх ролі в розвитку хламідійної інфекції з формуванням імунодефіциту були застосовані такі методи: цитологічні (“ранній” і “пізній“ фагоцитарний показник), цитохімічні (спонтанний та стимульований НСТ-тести), імунофлюоресцентні (лімфограма та активізаційні маркери лімфоцитів), нефелометричні (циркулюючі імунні комплекси), імуноферментні (специфічні IgM, IgG, IgA до С. trachomatis, IL-2, IL-4, IL-10, TNFa, INFg, HSP60, MOMP), біохімічні (загальна комплементарна активність сироватки крові за 50% гемолізом, сNOS та iNOS, NO2– –, NO3– – аніони), електронно-мікроскопічні та статистичні.
Наукова новизна одержаних результатів:
- Уперше з’ясовано особливості змін NО-залежної активності нейтрофілів та моноцитів крові щурів на формування у них фагоцитарного імунодефіциту з проявами глибоких структурних змін цих клітин за умов хронічного гіперімунокомплексного синдрому в експерименті;
- уперше оцінено поєднання гіперімунокомплексного синдрому хворих на хламідійну інфекцію з проявами імунодефіциту за кількісним та функціональним фагоцитарним типом;
- уперше оцінено прояви імунодефіциту в хворих на хламідійну інфекцію на основі адаптаційної гуморальної імунної відповіді, пов’язаної з інтенсивністю синтезу специфічних антитіл і їх авідністю;
- уперше охарактеризовано внутрішньоклітинні цитокіно-регуляторні механізми Т-хелперів 1 та 2 типів у хворих на хламідійну інфекцію в поєднанні з гіперімунокомплексним синдромом та імунодефіцитом.
Практичне значення одержаних результатів. Результати проведених досліджень дозволять:
- визначити вікові та статеві особливості хворих на хламідійну інфекцію, а також умови розвитку в них імунодефіциту;
- оцінити імунологічні критерії формування імунодефіциту на тлі хламідійної інфекції в хворих;
- діагностувати патогенетичні типи імунодефіциту (фагоцитарний, лімфоцитарний, антитілозалежний) та його клінічні форми (інфекційна, інфекційно-автоімунна) в хворих на хламідійну інфекцію;
- рекомендувати ранні діагностичні маркери автоімунних ускладнень хламідійної інфекції;
- диференційовано підійти до призначення патогенетичної імунотропної терапії в хворих на хронічний хламідіоз із проявами імунодефіциту.
Теоретичні та практичні узагальнення роботи викладені в інформаційному листі “Гіперімунокомплексний сидром в клініці та експерименті: діагностичні підходи“ (№227-2004) та актах впровадження, які використовуються в навчальному процесі кафедри патологічної фізіології Львівського національного медичного університету імені Данила Галицького, кафедри загальної і клінічної патофізіології Одеського державного медичного університету, кафедрах патологічної фізіології, внутрішньої медицини з клінічною імунологією та алергологією Тернопільського державного медичного університету імені І.Я. Горбачевського, на кафедрах патофізіології та ендокринології, клінічної імунології, алергології Донецького державного медичного університету ім. М. Горького, кафедрі клінічної імунології та алергології Hаціонального медичного університету ім. О.О. Богомольця.
Особистий внесок здобувача. Дисертаційна робота є самостійним науковим дослідженням. На основі проведеного інформаційного пошуку та літературного огляду автором спільно з науковим керівником сформульовано мету і завдання дослідження та обрано адекватну модель і методики. Під час виконання експериментальної частини здобувач брав участь у проведенні біохімічних, імунологічних та морфологічних досліджень. Автором самостійно були проконсультовані та відібрані хворі на хламідіоз, сформовані групи хворих. Імунологічні обстеження хворих проводились в імунологічних лабораторіях кафедри клінічної імунології та алергології Львівського національного медичного університету ім. Данила Галицького та Львівського регіонального медичного центру клінічної імунології та алергології, біохімічні дослідження – в Інституті біохімії ім. О.В. Палладіна НАН України, морфологічні – у лабораторії електронної мікроскопії Львівського національного медичного університету ім. Данила Галицького. Автор самостійно провів статистичну обробку результатів дослідження, проаналізував і узагальнив отримані результати, написав усі розділи дисертації. Висновки та практичні рекомендації сформульовано спільно з науковим керівником.
Апробація результатів дисертації. Основні положення дисертації оприлюднені на пленумі Наукового товариства патофізіологів України (Одеса, 2002), науково-практичному семінарі з міжнародною участю “Клінічна імунологія та алергологія: погляд у майбутнє” (Львів; Трускавець, 2004), IV національному конгресі патофізіологів України з міжнародною участю (Чернівці, 2004), науково-практичній конференції “Стан і перспективи розвитку медичної генетики, алергології та клінічної імунології” (Трускавець, 2005), VII науково-практичній конференції Українського товариства фахівців з імунології, алергології та імунореабілітації “Діагностика, та лікування TORCH-інфекцій та хламідіозу” (Київ, 2006), ІІ Національному конгресі з клінічної імунології та алергології “Сучасні здобутки клінічної імунології та алергології“ (Миргород, 2007).
Публікації. За матеріалами дисертації опубліковано 8 робіт, із них 5 статей у фахових наукових журналах рекомендованих ВАК України, 3 тези в матеріалах наукових з’їздів, конференцій та конгресів.
Структура дисертації. Дисертація викладена на 167 сторінках друкованого тексту і складається зі вступу, огляду літератури, опису матеріалів та методів досліджень, розділів результатів власних досліджень, аналізу і узагальнення результатів дослідження, висновків, списку використаних джерел та додатків. Текст дисертації проілюстрований 32 таблицями та 12 рисунками. Перелік використаних джерел містить 295 посилань, з яких 202 вітчизняні і 93 –зарубіжні. Бібліографічний опис літературних джерел, ілюстрації та додатки викладені на 41 сторінці.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали і методи досліджень. Експериментальні дослідження виконані на 42 статевозрілих білих щурах-самцях масою 200-250 г. Позаяк показники імунної системи змінюються залежно від пори року, дослідження проводили в осінньо-зимовий період. Експериментальні втручання та евтаназія тварин проводилась із дотриманням міжнародних принципів Європейської конвенції про захист хребетних тварин, які використовуються для експериментальних наукових досліджень (Страсбург, 1985), ухвали Першого національного конгресу з біоетики (Київ, 2000). Комісією з питань біоетики Львівського національного медичного університету ім. Данила Галицького (протокол від 15.12.2004 р. № 8) порушень до вимог не виявлено.
Модель хронічного гіперімунокомплексного синдрому створювали за допомогою класичної моделі Cohrane C. та Kofler D. у модифікації Williams. R. Усі експериментальні тварини були розділені на 2 серії: І серія – інтактні тварини, яким яким у хвостову вену кожні 7 днів упродовж 12 тижнів вводили фізіологічний розчин ( 20 тварин); ІІ серія – тварини з викликаним хронічним гіперімунокомплексним синдромом, яким у хвостову вену кожні 7 днів упродовж 12 тижнів вводили бичачий сироватковий альбумін із розрахунку 100 мг/кг ( 22 тварини).
Евтаназію тварин здійснювали шляхом декапітації. Кров для виділення нейтрофільних гранулоцитів забирали на гепарині (50 од. мл). Отримання клітин нейтрофілів, моноцитів проводили із застосуванням розчинів фікол-урографіну з густиною 1,077 г/мл та 1,095 г/мл. Виділені клітини використовували для проведення відповідних досліджень.
Для отримання сироватки крові периферичну кров витримували впродовж однієї год. в термостаті при температурі 370 С та однієї год. при температурі +40 С. Сироватку крові відбирали після центрифугування крові при 1500 об/хв. через 10 хв.
Клінічні дослідження були проведені у 2002–2007 роках у Львівському регіональному медичному центрі клінічної імунології та алергології, а також у Львівській обласній клінічній лікарні на базі ревматологічного відділення: було обстежено 150 хворих на хламідійну інфекцію у віці 18–50 років. Діагноз хламідійної інфекції встановлювали на основі діагностичних критеріїв урогенітальних та офтальмологічних хламідіозів, реактивних артритів хламідійного ґенезу, хламідійних бронхітів, бронхіальної астми, неревматичних вад серця та хвороби Рейтера хламідійного ґенезу (Джус М.Б., 1999). Серед них 39 хворих мали прояви імунодефіцитів згідно з протоколом експертів ВООЗ (1998).
У досліджуваній роботі були виділені такі групи хворих на хламідійну інфекцію: жінки – 82 хворих та чоловіки – 68 хворих; хворі віком до 35-ти років – 57 хворих, 35 і більше років – 93 хворі, з гіперімунокомплексним синдромом – 55 хворих, без цього синдрому 95 – хворих, з проявами імунодефіциту – 39 хворих, серед них 19 жінок і 20 чоловіків, у віці до 35-ти років – 22 хворих, 35 і більше років – 17 хворих, з хворобою Рейтера 11 – хворих.
До контрольної групи увійшли 31 практично здорова особа в віці від 18-ти до 40-ка років, з них 16 жінок і 15 чоловіків.
Розвиток гіперімунокомплексного синдрому оцінювали за рівнем циркулюючих імунних комплексів (ЦІК) у сироватці крові та її загальною комплементарною активністю, а також на основі структуральних змін клітин-мішеней – ендотеліоцитів. Для оцінки фагоцитарної ланки імунної системи проводили визначення їх фагоцитарної активності, а також окисно-відновних ферментативних процесів. Метаболізм оксиду азоту в нейтрофілах, моноцитах та сироватці крові щурів досліджували: за рівнем активності ферментів індуцибельної і конститутивної NO-синтаз та за вмістом його кінцевих метаболітів – нітрит- і нітрат-аніонів. Морфологічний стан і резервні можливості поліморфноядерних лейкоцитів та мононуклеарних фагоцитів оцінювали за допомогою методу електронної мікроскопії.
Дослідження активності ферментів NO-синтаз, вмісту нітрит- і нітрат-аніонів виконував в Інституті біохімії ім. О. В. Палладіна під керівництвом к.б.н, ст.н.сп. Коцюруби А. В., за що висловлюю йому щиру подяку. Електронно-мікроскопічні дослідження проведено в лабораторії електронної мікроскопії Львівського національного медичного університету ім. Данила Галицького під керівництвом к.б.н. Ковалишина В.І., за що висловлюю йому щиру подяку. Імунологічні дослідження виконані на базі імунологічних лабораторій кафедри клінічної імунології та алергології Львівського національного медичного університету ім. Данила Галицького та лабораторно-діагностичного відділу Львівського регіонального медичного центру клінічної імунології та алергології, за що висловлюю щиру вдячність завідуючим – к. м. н. Вальчук І.В. та Вільховій Т.К.
Основні результати досліджень та їх обговорення.
Підтвердженням коректної моделі хронічного імунокомплексного синдрому було стійке збільшення рівня патогенних ЦІК у сироватці крові в 46% дослідних тварин та виражені структуральні зміни мішеневих клітин – ендотеліоцитів аорти, які характеризувалися значним пошкодженням мембран цих клітин, накопиченням у цитоплазмі білкових депозитів та ядерною деструкцією.
Встановлено, що при експериментальному хронічному гіперімунокомплексному синдромі абсолютний (Р<0,001) та відносний (Р<0,01) показники спонтанного НСТ–тесту, індекс його стимуляції (Р<0,001), а також рівень циркулюючих імунних комплексів (Р<0,01) були підвищеними в групі дослідних тварин. Водночас, “пізнє” фагоцитарне число (Р<0,01), активність загального комплементу сироватки крові (Р<0,05) в цих тварин були зниженими. Такі зміни фагоцитарної ланки імунної відповіді всіх експериментальних тварин за умов хронічного гіперімунокомплексного синдрому можуть свідчити про активне персистування патогенних комплементзалежних імунних комплексів, із посиленням окисно-відновних процесів у цих клітинах і виснаженням кількісної захоплювальної активності фагоцитів у пізній фазі.
У дослідних тварин із верифікованою гіперімунокомплексемією поглиблювалося порушення “пізньої” захоплювальної здатності фагоцитів, що характеризувалася зниженням відповідного фагоцитарного показника (Р<0,02) та фагоцитарного числа (Р<0,001). У цій групі також була слабша окисно-відновна активність стимульованого НСТ-тесту (Р<0,05) і, відповідно, нижчий індекс стимуляції (Р<0,05) у порівнянні з тваринами без гіперімунокомплексемії. Важливо зазначити, що у тварин із хронічною гіперімунокомплексемією було наявне вираженіше зниження загальної комплементарної активності сироватки (Р<0,01), що може свідчити про посилену агресивність таких комплементфіксованих ЦІК з ризиком розвитку автоімунних ускладнень надалі.
Особливо цікавими виявились результати показників синтезу оксиду азоту в нейтрофілах, моноцитах та сироватці крові щурів з хронічним гіперімунокомплексним синдромом. У всіх дослідних тварин спостерігалося вірогідне зниження рівня конституційної NO-синтази в цих клітинах (Р<0,01) водночас із зростанням рівня індуцибельної NO-синтази в нейтрофілах (Р<0,05) та в сироватці крові (Р<0,01).
Рис. 1. Активність сумарної конститутивної та індуцибельної NO-синтази в нейтрофілах, моноцитах та сироватці крові щурів у нормі при хронічному гіперімунокомплексному синдромі
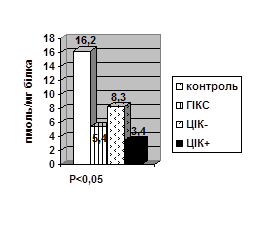
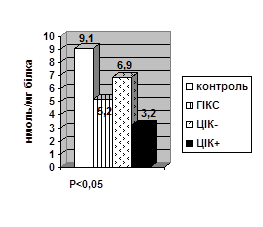
За умов серологічної гіперімунокомплексемії в дослідних тварин спостерігалось значне зниження конститутивної NO- синтази в нейтрофілах (Р<0,01) та моноцитах (Р<0,001), на тлі збільшення індуцибельної NO- синтази в нейтрофілах (Р<0,01) та моноцитах (Р<0,05), а особливо в сироватці крові (Р<0,001), порівняно з тваринами без підвищення рівня ЦІК у крові (рис. 1).
Зміни рівня метаболітів синтезу NO теж мали свої особливості. Так, рівень NO2 ˉ-аніонів знижується в нейтрофілах (Р<0,01) і моноцитах (Р<0,01) зі зростанням їх рівня в сироватці крові (Р<0,05). Аналогічні тенденції змін рівня NO2 ˉ-аніонів у фагоцитах та сироватці крові спостерігалися в тварин з серологічно позитивними ЦІК, порівняно з тваринами без підвищених ЦІК у крові. Але вірогідним було тільки підвищення рівня NO2 ˉ-аніону в сироватці крові (Р<0,05) тварин з гіперімунокомплесемією (рис. 2).
|
|
|
8-09-2015, 23:16
