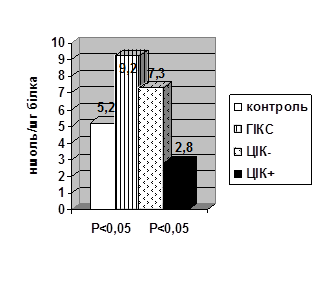
Рис. 2. Рівень NO2 ˉ-аніонів у нейтрофілах, моноцитах та сироватці крові щурів у нормі, при хронічному гіперімунокомплексному синдромі
Рівень NO3 ˉ-аніонів також вірогідно знижувався в нейтрофілах (Р<0,05), моноцитах (Р<0,05) дослідних тварин, але в сироватці крові без вірогідної різниці (рис. 3). За умов серологічно верифікованої гіперімунокомплексемії тенденції у змінах рівнів NO3 ˉ-аніонів зберігались в нейтрофілах та моноцитах, та ось у сироватці крові зниження рівня NO3 ˉ- аніону в цієї групи тварин стало вірогідним (Р<0,05), що видно з рисунку 3.
Вказані особливості обміну оксиду азоту в клітинах фагоцитарної системи можуть свідчити про значний імунозапальний потенціал у нейтрофілах та сироватці крові щурів із хронічним гіперімунокомплексним синдромом. За умов серологічнопідтвердженої гіперімунокомплексемії метаболізм цієї сполуки характеризвся вираженішим збільшенням рівнів індуцибельної NO-синтази та зниженням потенціалу конститутивної NO-синтази, в нейтрофілах, а також в моноцитах, з особливим наростанням рівня індуцибельної NO-синтази в сироватці крові цієї групи тварин. Водночас, рівень “агресивного” метаболіту оксиду азоту NO2 ˉ також збільшувався, хоч менш значуще, а “захисного” метаболіту NO3 ˉ – зменшувався, ймовірно, створюючи умови для NO-залежного і оксидазного стресу, особливо в ЦІК-позитивних тварин.
|
|
|
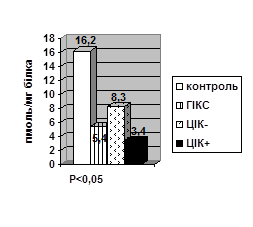
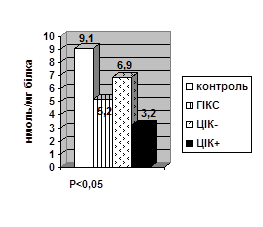

Рис. 3. Рівень NO3 ˉ-аніонів у нейтрофілах, моноцитах та сироватці крові щурів у нормі, при хронічному гіперімунокомплексному синдромі
Ці фактори засвідчують про сприятливі умови для стійкої активації прозапальних цитокінів, розвитку автоімуноагресії та подальшого підтримання гіперімунокомплексемії. За цих умов особливо страждає кілінгова функція фагоцитів, сприяючи накопиченню ЦІК на клітинах-мішенях, а також їх преципітації в судинному мікроциркуляторному руслі (Malinski T., 2004). За таких умов поглиблюються прояви фагоцитарного імунодефіцитів та формується сприятливе тло для млявого автоімунного запального ушкодження (Memtovani B., 2006).
Верифікуванням цих тверджень були морфо-функціональні зміни головних ефекторних клітин хронічного гіперімунокомплексного синдрому – нейтрофілів і моноцитів крові дослідних щурів при електронно-мікроскопічних дослідженнях. Полінуклеарні клітини характеризувалися тотальним набряком цитоплазми, структурованістю хроматину, збільшенням кількості первинних та вторинних лізосом, піноцитозних везикул. Моноцити дослідних тварин мали прояви пошкодження мембрани, розриву та набухання ядерної оболонки та мітохондрій.
Таким чином, можна стверджувати, що тривала персистенція ЦІК у сироватці крові дослідних тварин є результатом порушення захоплювальної ферментативної, окисно-відновної та метаболічної NO-залежної активності нейтрофілів та моноцитів крові з формуванням фагоцитарного типу імунодефіциту за патогенезом.
Механізми розвитку експериментального гіперімунокомплексного синдрому та кількісно-функціонального фагоцитарного дефіциту можуть переплітатися з перебудовою імунної відповіді в хворих на хронічний хламідіоз, особливо за умов клінічно сформованого імунодефіциту.
Екстраполювати отримані експериментальні результати на хворих з хронічним хламідіозом, які зверталися на консультацію в регіональний медичний центр клінічної імунології і алергології та лікувалися в ревматологічному відділенні Львівської обласної клінічної лікарні виявилось досить аргументованим кроком, бо частина з них мали клініко-імунологічні ознаки гіперімунокомплексного синдрому, імунодефіциту та автоімунних ускладнень.
Проведений детальний анамнестично-клінічний аналіз всіх хворих на хронічний урогенітальний хламідіоз, а також на реактивні артрити, кератокон’юнктивіти, хронічні бронхіти, бронхіальну астму, неревматичні вади серця, хворобу Рейтера хламідійного ґенезу. На основі мікробіологічних молекулярно-генетичних, імунофлюоресцентних, імуноферментних досліджень був верифікований діагноз хламідіозу. На основі ДНК-діагностики методом полімеразно-ланцюгової реакції встановлена присутність ДНК-копій С. trachomatis у крові 46,1% хворих, в зішкрябах – 71,5% хворих (урогенітальні, офтальмологічні, суглобові прояви), а С. pneumoniae в крові – 72,9% хворих, в зішкрябах – 82,7% хворих (респіраторні та кардіологічні прояви).
Проведені порівняння у хворих на хламідійну інфекцію, викликану різними хламідіями: С. trachomatis та С. pneumoniae, за всіма досліджуваними показниками, показали, що вірогідних змін між цими групами хворих не встановлено, незважаючи на різну клінічну картину цих хламідійних захворювань (урогенітальні, реактивні артрити, хронічні атипові бронхіти, пневмонії, бронхіальна астма, неревматичні вади серця).
У хворих на хламідіоз при проведенні імунологічних досліджень встановлено гіперімунокомплексемію в 33,6 % обстежених. Клінічні прояви імунодефіциту були виявлені в 26% хворих, які характеризувались частими рецидивами хронічної інфекції (більше 4 разів у рік), атиповим перебігом, нечутливістю до етіотропної терапії, навіть комбінованими та супресивними схемами, тривалим субфібрилітетом, синдромом хронічної втоми, стійкими функціональними розладами органів-мішеней, мікозами, піодерміями. Клініко-лабораторні прояви автоімунних ускладнень з розвитком хвороби Рейтера були діагностовані у 9,3 % хворих.
Важливим виявився аналіз асоціацій гіперімунокомплексного синдрому та імунодефіциту в хворих на хламідіоз і їх вікові та статеві особливості, визначення патогенетичного типу імунодефіциту, його клінічного виду при проведенні імунологічних обстежень цих хворих.
Був проведений аналіз зміни первинної ланки природженого клітинного імунного нагляду в хворих на хламідіоз, а саме оцінка стану фагоцитарної системи. Як показали проведені дослідження, в хворих на хламідійну інфекцію встановлено зниження фагоцитарного показника (Р<0,05), індексу стимуляції НСТ-тесту (Р<0,05) на тлі гіперімунокомплексного синдрому (Р<0,01), який був більш виражений у чоловіків (Р<0,05). Серологічно позитивний синдром гіперімунокомплексемії в хворих поглиблював зниження захоплювальної та окисно-відновної активності фагоцитів. У хворих на хламідійну інфекцію з проявами імунодефіциту система фагоцитозу зазнавала вірогідної депресії в поглинальній активності (Р<0,01), резервній здатності до окисно-відновних процесів (Р<0,05) на тлі наростання гіперімунокомплексного синдрому (Р<0,02) та споживання комплементу (Р<0,05). У чоловіків хворих на на хламідійну інфекцію з проявами імунодефіциту, спостерігався вірогідно нижчий фагоцитарний показник (Р<0,05) та вищий рівень ЦІК (Р<0,001), особливо у хворих віком більше 35 років та в хворих на хворобу Рейтера.
Вказані особливості фагоцитарної системи в хворих на хламідійну інфекцію характеризувалися послабленням захоплювальної та спонтанної кілінгової активності цих клітин. У обстежених хворих із гіперімунокомплексним синдромом долучалась знижена потенціальна активність окисно-відновних процесів у фагоцитах. У хворих на хламідійну інфекцію з імунодефіцитом ці процеси поглиблювались з виснаженням резервної здатності моно- і полінуклеарів крові. Хвороба Рейтера характеризувалася більш вираженішим зниженням фагоцитарного показника, депресією індексу стимуляції НСТ-тесту, наростанням гіперімунокомплексемії.
Таким чином, отримані дані свідчать, що фагоцитарна ланка імунної відповіді в хворих на хламідійну інфекцію є пошкодженою, а у хворих із імунодефіцитом її резервні можливості ще більше виснажені, що може сприяти хронічній персистенції патогенних ЦІК. Встановлені виражені взаємозв’язки гіперімунокомплексемії та імунодефіциту в 70,9% хворих, особливо в чоловіків і у хворих віком більше 35 років. Гіперімунокомплексний синдром може бути патогенетичною ланкою формування автоімунних ускладнень хламідійної інфекції, зокрема, супроводжувати розвиток хвороби Рейтера у 20% хворих, а на тлі імунодефіциту – в 28,2% хворих.
У результаті аналізу лімфограм хворих на хламідійну інфекцію встановлено зниження регуляторного індексу (Р<0,01), підвищення кількості NК-клітин (Р<0,02) та активованих IL-2 лімфоцитів. У чоловіків, хворих на хламідіоз, було вірогідно нижче число цитотоксичних лімфоцитів (Р<0,05). Гіперімунокомплексний синдром у хворих на хламідійну інфекцію супроводжувався зниженням загальної кількості Т-лімфоцитів (Р<0,05), особливо цитотоксичних Т-лімфоцитів (Р<0,001), та збільшенням регуляторного індексу (Р<0,02). За умов імунодефіциту в хворих на хламідійну інфекцію встановлено вірогідне зниження загальної кількості Т-лімфоцитів (Р<0,001), Т-хелперів (Р<0,001), NК-клітин (Р<0,01) ранньоактивованих (Р<0,01) та пізньоактивованих (Р<0,05) лімфоцитів. Абсолютна кількість регуляторних лімфоцитів зростала в чоловіків цієї групи (Р<0,05), а також у хворих вікової групи 35 і більше років (Р<0,01). Індекс кореляції між кількістю імунорегуляторних лімфоцитів у хворих на хламідіоз та з проявами імунодефіциту становить r = +0,6. У хворих на хворобу Рейтера спостерігалось наростання імунорегуляторного індексу лімфоцитів (Р<0,001) і значне зниження кількості CD4+ /25+ -субпопуляції Т-лімфоцитів (Р<0,001).
Такі зміни в кількісному складі лімфоцитів та їх субпопуляцій, особливо у хворих на хламідіоз із проявами імунодефіцитів та гіперімунокомплексним синдромом, свідчать про розвиток кількісно-функціонального лімфоцитарного імунодефіциту. За таких умов пошкоджується забезпечення протиінфекційного імунного захисту від внутрішньоклітинних збудників і стає можливою хронізація процесу. Послаблення лімфоцитарних гальмівних механізмів у хворих вказаних груп, особливо чоловіків, створює передумови для розвитку автоімунних ускладнень, зокрема хвороби Рейтера.
Цитокіновий баланс як функціональна характеристика стану природженого та набутого клітинного імунного нагляду в хворих досліджуваних груп теж мав свої особливості. Так,у хворих на хламідійну інфекцію спостерігалося зростання рівня тумор-некротичного фактору-б (Р<0,001) та імунорегуляторного індексу Т-хелперів першого типу – INFг/IL2 (Р<0,05), що супроводжувалося вірогідним зростанням рівня IL-2 (Р<0,05), особливо в жінок, і не залежано від віку хворих. У пацієнтів з гіперімунокомплексним синдромом ці тенденції змін цитокінової перебудови поглиблювалися, але без вірогідності. Встановлено взаємозв’язок між співвідношенням Т-хелперів ІІ типу (IL10/IL4) та кількістю регуляторних Т-лімфоцитів (r = +0,71), а також відсотком низькоавідних антитіл (r = +0,50). Крім того, було встановлено, що рівень IL-2 обернено пропорційно корелював з кількістю регуляторних Т-лімфоцитів (r = + 0,51) та рівнем IL-10 (r = + 0,50).
Імунодефіцит на тлі хламідійної інфекції супроводжувався в хворих зниженням рівня TNFб (Р<0,01) та ІNFг (Р<0,05), а також індексу Т-хелперів першого типу – INFг/IL2 (Р <0,001) та збільшенням рівнів у сироватці крові IL-2 (Р<0,05) та IL-10 (Р<0,02), порівняно з хворими без проявів імунодефіциту. Наведені зміни цитокінів у даних хворих не залежали від віку та статі. У хворих на хворобу Рейтера активізувався синтез IL-4 (Р<0,02) та знизився синтез IL-10 (Р<0,01) порівняно з хворими на хламідійну інфекцію з проявами імунодефіциту.
Таким чином, зміни цитокінового балансу в хворих на хламідійну інфекцію свідчили про активну гуморальну неспецифічну імунну відповідь зі стійкими запальними проявами, які поглиблювалися за умов імунодефіцитів і формували сприятливі умови для хронізації процесу і механізмів автоагресивних пошкоджень.
Аналіз проведених імунологічних досліджень адаптивної гуморальної ланки імунної системи в хворих на хламідійну інфекцію засвідчив, що специфічний антитілогенез у них активно підвищений за всіма класами імуноглобулінів, а особливо в жінок – за рівнем продукції IgА (Р<0,05). За умов проявів імунодефіциту в хворих на хламідійну інфекцію рівень синтезу специфічного IgG (Р<0,001) та його індекс (Р<0,01) були зниженими з наростанням відсотка низькоавідних антитіл (Р<0,05), у порівнянні з хворими без цих проявів. Також у цієї групи хворих встановлено підвищення рівня маркера автоімунної агресії – НSP 60 (Р<0,01), і особливо в осіб чоловічої статі (Р<0,01).
Таким чином, у хворих на хламідійну інфекцію синтез специфічних антитіл був активований, а у хворих із проявами імунодефіциту специфічна гуморальна імунна відповідь - зниженою за рахунок зменшення інтенсивності синтезу імуноглобуліну класу G, а можливо через структуральні зміни цього класу антитіл. Встановлено кореляцію низькоавідних антитіл із проявами імунодефіцитів. Гуморальний маркер хламідійної інфекції виявлено в усіх обстежених хворих, але вищий його рівень спостерігався у хворих з гіперімунокомплексним синдромом (Р<0,05). Неспецифічний предиктор автоімунного синдрому - НSР 60 був особливо підвищений у хворих на хворобу Рейтера (Р<0,01).
Підсумовуючи проведені дослідження, можна зазначити, що експериментальний хронічний гіперімунокомплексний синдром характеризувався морфофункціональним пошкодженням фагоцитів, особливо послабленням їх резервних ферментативних можливостей та наростанням NO-залежних індуцибельних механізмів у нейтрофілах та сироватці крові, що створювало умови для активації автоагресивних механізмів.
У хворих із хронічною хламідійною інфекцією провідною ланкою патогенезу був саме гіперімунокомплексний синдром, який поглиблював зміни фагоцитарної ланки, зумовлював дисбаланс лімфоцитарного та цитокінових імунорегуляторних факторів, зміну активності специфічного антитілогенезу та сприяв формуванню різних типів імунодефіциту в хворих на хламідійну інфекцію. Перебіг хронічної хламідійної інфекції з імунодефіцитними проявами зумовлював розвиток стійких змін фагоцитарної та антитілозалежної імунної відповіді з формуванням гуморальних та лімфоцитарних механізмів автоагресії на тлі хламідіозу.
Проведені клініко-імунологічні дослідження хворих на хламідіоз можуть вивести наступні взаємозв’язки між хронічною хламідійною інфекцією та імунодефіцитами. Так, було встановлено у 26 % хворих прояви імунодефіциту який супроводжувався гіперімунокомплексним синдромом у всіх обстежених та у 28,2 % спостерігався розвиток автоімунного ускладнення хламідійної інфекції - хвороби Рейтера.
ВИСНОВКИ
У дисертаційній роботі наведені нові теоретичні узагальнення результатів дослідження і по-новому вирішене наукове завдання, що полягає у з’ясуванні механізмів фагоцитарних порушень і хронічної персистенції ЦІК, яка супроводжує хронічну хламідійну інфекцію. Запропоновані нові підходи до оцінки імунопатогенезу хронічного хламідіозу та його взаємозв’язки з гіперімунокомплексним синдромом та імунодефіцитом.
1. Експериментальна хронічна персистенція ЦІК у сироватці крові є результатом порушення захоплювальної, окисно-відновної активності нейтрофілів і моноцитів крові з проявами фагоцитарного імунодефіциту, який за умов серопозитивної гіперімунокомплексемії характеризувався поглибленим зниженням “пізнього” фагоцитозу та резервного потенціалу окисно-відновних процесів.
2. Метаболізм оксиду азоту в нейтрофілах та сироватці крові дослідних тварин характеризувався активацією індуцибельних процесів із послабленням гальмівних факторів NO-залежного стресу в фагоцитах, що підтверджувалося морфо-функціональними змінами ефекторних клітин – нейтрофілів та моноцитів, а також мішеневих клітин – ендотеліоцитів.
3. Особливості фагоцитарної системи в хворих на хламідійну інфекцію з імунодефіцитними проявами характеризуються послабленням “пізньої” захоплювальної та “потенціальної” кілінгової активності цих клітин, особливо в чоловіків та хворих віком 35 і більше років.
4. Фенотипування лімфоцитів та їх субпопуляцій за умов хронічної хламідійної інфекції з проявами імунодефіциту свідчило про послаблення гальмівних лімфоцитарних механізмів, що створювали умови автоімунних ускладнень.
5. Зміни цитокінового балансу свідчили про включення прозапальних факторів за умов хламідійної інфекції з гіперімунокомплексним синдромом, що створювало сприятливі умови для хронізації процесу, а дисрегуляція цитокінів Тh-1 та Тh-2 –для розвитку імуноавтоагресивних ускладнень.
6. У хворих на хронічну хламідійну інфекцію специфічний антитілогенез був посилений, особливо в жінок, за рахунок підвищеного рівня IgА, а у хворих із проявами імунодефіциту специфічна гуморальна імунна відповідь була послабленою зі зменшенням синтезу специфічно відповідних IgG та низькою авідністю цих антитіл.
7. Гуморальний предиктор ускладнення хламідійної інфекції – HSP 60 був підвищений у хворих на хворобу Рейтера, частіше в хворих чоловічої статі та в віковій групі 35 і більше років.
8. На основі клінічних та лабораторних імунологічних досліджень у 33,6 % був встановлений гіперімунокомплексний синдром, який супроводжував всі випадки стійких проявів імунодефіциту – в 26,0 % хворих, зокрема різних їх типів: фагоцитарною, лімфоцитарною, антитілозалежною, змішаною, а в 28,2 % серед цієї групи хворих було діагностовано автоімунне ускладнення – хвороба Рейтера
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ НА ТЕМУ ДИСЕРТАЦІЇ
1. Чоп’як В.В., Синенька М.Ю., Синенький О.В., Гайдучок І.Г. Лікування реактивних артритів хламідійного та герпетичного ґенезу // Мистецтво лікування. – 2005. – №3. – С. 100–104. (Здобувач виконав клінічний підбір хворих для обстеження, підготував публікацію до друку).
2. Федоров Ю.В., Чоп’як В.В., Гайдучок І.Г. Молекулярно-генетичні та серологічні дослідження ймовірної патогенетичної ролі Chlamidia pneumoniae i Cytomegalovirus при кальцинуючій хворобі клапанів серця // Серце і судини. – 2005. – №3. – С. 70–75. (Здобувач виконав клінічний підбір хворих для обстеження, статистичне опрацювання отриманих результатів).
3. Чоп’як В.В., Потьомкіна Г.О., Пукаляк Р.М., Ліщук-Якимович Х.О., Вальчук І.В., Гайдучок І.Г., Білянська Л.М., Білянський Ю.В. Клінічні форми перебігу вторинного імунодефіциту хламідійного ґенезу // Імунологія та алергологія. – 2006. – №4. – С. 115–116. (Здобувач виконав клінічний підбір хворих для обстеження, статистичне опрацювання отриманих результатів).
4. Чоп’як В.В., Вальчук І.В., Гайдучок І.Г., Садляк О.В., Качмарська М.О., Никитюк Г.П. Гіперімунокомплексний синдром в експерименті та клініці // Вісник наукових досліджень. – 2007. – №1. – С. 5–8. (Здобувач виконав клінічний підбір хворих для обстеження, провів пошук літератури в науковій бібліотеці та мережі Medline, підготував статтю до друку).
5. Садляк О.В., Чоп’як В.В., Вальчук І.В., Гайдучок І.Г. Хронічний гіперімунокомплексний синдром: коригуючий вплив корвітину на метаболізм L- аргініну в лімфоцитарно-ендотеліальних взаємодіях in vitro // Імунологія та алергологія. – 2007. – № 1. – С. 63–66. (Здобувач прийняв участь у виконанні досліджень, провів аналіз експериментальних даних).
6. Гайдучок І. Г. Особливості імунологічних показників у хворих на часторецидивуючий хронічний генітальний хламідіоз // Імунологія та алергологія. – 2007. – № 2. – С. 37-39. (Здобувач виконав клінічний підбір хворих для обстеження, статистичне опрацювання отриманих результатів, підготував статтю до друку).
7. Чоп’як В.В., Ліщук-Якимович Х.О., Пукаляк Р.М., Гайдучок І.Г. Діагностика інфекційних імунодефіцитів у Західноукраїнському медичному центрі клінічної імунології та алергології // Матеріали Х конгресу світової федерації українських лікарських товариств. (Чернівці – Київ – Чікаго) 2004. – С. З91. (Здобувач виконав клінічний підбір хворих для обстеження, статистичне опрацювання отриманих результатів, підготував статтю до друку).
8. Chopyak V., Potomkina H., Lishchuk K., Pukalyak R., Zajchenko, GajduchocI., Du Buske I., Du Buske L. Compleх therapy of IgE – dependent astma //Allergy. – 2007. – Vol. 62, Supl. 83. – P. 208. (Здобувач виконав клінічний підбір хворих для обстеження, провів пошук літератури в науковій бібліотеці та мережі Medline, підготував статтю до друку).
АНОТАЦІЯ
Гайдучок І. Г. Взаємозв’язки хламідійної інфекції та імунодефіциту: імунопатогенез та імунодіагностика. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.03.04 – патологічна фізіологія. – Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України. Тернопіль, 2008
Дисертаційна робота присвячена вивченню особливостей функціонально-структурних змін фагоцитів за умов гіперімунокомплексного синдрому в експерименті та його ролі в розвитку хламідійної інфекції з формуванням імунодефіциту в клініці. За умов експериментального гіперімунокомплексного синдрому виявлено значні морфо-функціольні пошкодження фагоцитів, особливо резервних окисно-відновних можливостей зі зниженням індексу стимуляції НСТ-тесту та наростанням NO-залежних індуцибельних процесів, у послабленні гальмуючих: конституційної NO-синтази та NO3–
-аніонів. У хворих на хламідійну інфекцію встановлено, власне, домінуючий взаємозв’язок гіперімунокомплексного синдрому, який поглиблював зміни фагоцитарної системи: імунорегуляторних факторів імунної відповіді зі зниженням потенціалу окисно-відновних процесів у них, власне, з формуванням різних типів імунодефіциту в хворих на хламідійну інфекцію та поглибленням хронізації процесу. Імунодефіцит ускладнював перебіг хронічної хламідійної інфекції, зумовлював стійкі зміни імунорегуляторних механізмів імунної
8-09-2015, 23:16
