Для лікування відбирали соматично здорових пацієнтів, хворих на ГП хронічного і загостреного перебігу початкового, І і ІІ ступеня, яких було поділено на дві групи: до основної (І) увійшли пацієнти, в комплексному лікуванні яких, крім базової терапії, використовували розроблений нами спосіб із застосуванням препарату „Спіруліна” (ВАТ „ХФЗ „Червона зірка”, м. Харків; реєстраційне посвідчення Р.0600/01891); до контрольної (ІІ) – хворі, яким застосовували лише базову терапію з включенням препарату „Мульти-табс”. У комплексному лікуванні ГП спіруліну ми застосували вперше (Деклараційний патент України на винахід № 47692 від 15.07.2002). Після традиційної базової терапії хворим І групи (223 осіб) призначали спіруліну всередину по 1,0 г 3 рази на добу після їжі; курс лікування склав 4 тижні. Для аплікацій та інстиляцій ex tempore готували пасту таким чином: на скляній пластинці замішували гранули спіруліни та порошок ентеросорбенту „Силлард П” (1:1) із 0,05% розчином хлоргексидину біглюконату. Пасту накладали на 20-25 хв, курс лікування склав 6-8 процедур, які здійснювали через 1-2 дні. 108 хворим ІІ групи всередину призначали мульти-табс, а місцевого використовували іммоблізований на сорбенті „Силлард П” 0,05% розчин хлоргексидину біглюконату. Курс лікування за тривалістю не відрізнявся від такого у хворих основної групи. Оцінку ефективності здійснювали порівняльним аналізом клінічних, цитогенетичних, біохімічних та імунологічних показників до і після лікування та через 6, 12 і 24 місяці. Кожні 6 місяців хворих оглядали і проводили підтримуючу терапію: професійну гігієну і за необхідності – курс місцевого лікування. Усім хворим через рік призначали повторно курс препаратів усередину, а у разі ГП ІІ ступеня ще й місцеву підтримуючу терапію.
Статистичну обробку отриманих результатів здійснювали за допомогою прикладних програми (пакет «STATISTICA 6.0»). Матеріал обробляли методами описової статистики і застосували метод аналізу відмінності з використанням t-критерію Ст’юдента, а також кластерний, дискримінантний, кореляційний (використовували коефіцієнти Пірсона і Спірмена) та факторний аналізи.
Результати дослідження та їх обговорення. У здорових, хворих на ГП і пародонтоз вивчено 32 найінформативніші ДГ показники. Дискримінантним аналізом доводили належність досліджуваних осіб до клінічно визначених нами виборок. Встановлено, що при зіставленні виборок „здорові – ГП” правильність занесення чоловіків у відповідні групи склала 96,4% (у здорових) та 92,4% (у хворих на ГП), а в жінок – 100% і 97,4% відповідно. У випадку дослідження „здорові – пародонтоз” відповідність зарахування пацієнтів у групи склала: у здорових чоловіків – 78,4%, у жінок – 67,4%, а у хворих на пародонтоз – відповідно 82,4% та 97,1%. Узгодження клінічних і ДГ даних щодо розподілу пацієнтів за діагнозами свідчить про високу діагностичну надійність ДГ методу, особливо при діагностиці пародонтозу. Отже, дискримінантний аналіз ДГ показників може бути використаний для доклінічної діагностики ГП і пародонтозу. Дослідженням парних коефіцієнтів кореляцій кожної із ДГ характеристик у всіх обстежених виявлено різну кількість сильних і середніх взаємозв’язків: у здорових, хворих на ГП і пародонтоз чоловіків – 101, 73 і 108, а в жінок – 100, 81 і 198 відповідно. Це вказує на суттєвий вплив спадкового фактора на виникнення і розвиток хвороб пародонта, особливо пародонтозу у жінок. За допомогою методу канонічних кореляцій підтверджено сильний зв’язок ДГ характеристик із виникненням пародонтозу (r>0,99 у чоловіків і r>0,97 у жінок) і середній – із захворюванням на ГП (r>0,39 у чоловіків і r>0,34 у жінок). Отримані результати доводять, що пародонтоз належить до захворювань, у виникненні яких спадковий чинник є провідним, а розвиток ГП зумовлений і спадковими, і середовищними (наприклад, бактеріальним нальотом, палінням тощо) факторами, які чинять сумісну кумулятивну дію. Факторним аналізом , який дає змогу виявити діагностичні критерії до ГП і пародонтозу, виділено три головних фактори, у яких міститься приблизно така ж інформація, що й у значно більшому числі спостережень. Факторизація кореляційних матриць ДГ ознак виявила їх особливості залежно від захворювання і статі обстежуваних осіб (чітко простежувався статевий диморфізм). Встановлено найінформативніші ДГ ознаки для здорових, хворих на ГП і пародонтоз чоловіків і жінок (домінуючі гребеневі рахунки і малюнки на пальцях рук; малюнки у міжпальцевих проміжках; малюнки на гіпотенарі і тенарі; закінчення ліній долоні А, В, С, Д; згинальні складки долоні; кут atd ) та доведено, що при складанні прогнозу розвитку хвороб пародонта необхідно врахувати не менше шести ДГ показників. Отже, проведений нами комплексний математичний аналіз дозволяє з високим ступенем достовірності прогнозувати схильність до розвитку ГП чи пародонтозу.
При вивченні розподілу антигенів груп крові системи АВ0 серед населення м. Івано-Франківська та області встановлено суттєві відмінності між обстеженими. У здорових і хворих на ГП чоловіків ідентифікували всі групи, проте група 0 у разі ГП зустрічалася у 2,06 (p>0,05) раза частіше, а група АВ – у 2,72 (p<0,01) раза рідше, ніж у здорових. У хворих на пародонтоз групи АВ не виявлено, і за цим показником вони достовірно відрізнялися від здорових (p<0,005), а групу 0 фіксували у 2,07 (p>0,05) раза частіше. При порівнянні даних хворих на ГП і пародонтоз чоловіків вірогідної різниці не встановлено. У здорових жінок група АВ не зустрічалася, а у разі ГП виявлено всі групи. У хворих на пародонтоз жінок не фіксували групи В, що було достовірно відмінним від здорових (p<0,005), а групу АВ, якої не було у здорових, ідентифікували у 12,5% осіб (p<0,005). За відсутністю групи В хворі на пародонтоз жінки вірогідно відрізнялися від хворих на ГП (p<0,05). У всіх обстежених встановлено статевий диморфізм, але якщо у здорових суттєву різницю спостерігали за двома групами – 0 і АВ, то у хворих на ГП – за трьома – 0; А і АВ, а у разі пародонтозу, – за чотирма, особливо за В і АВ. Спільною рисою для всіх обстежених була наявність у здорових, хворих на ГП і пародонтоз статевого диморфізму за групою 0. За іншими показниками гендерні відмінності були різними.
За асоціаціями груп крові систем АВ0 і Rh також встановлено суттєві відмінності. Зокрема, у здорових чоловіків не зустрічали асоціацію 0 і Rh-, а у хворих на ГП були всі асоціації. При пародонтозі у чоловіків не ідентифіковано асоціацій В і Rh-; АВ і Rh+ та АВ і Rh-. Найістотніші відмінності між здоровими і хворими на ГП чоловіками виявлено за асоціацією АВ і Rh+, яка визначалася при ГП у 2,84 (p<0,05) раза рідше. За пародонтозу у чоловіків суттєву різницю зі здоровими спостерігали за асоціаціями 0 і Rh- (встановлювали у 13,4% хворих і не виявляли у здорових; p<0,05) та АВ і Rh+, якої не було у хворих (p<0,05). Показники хворих на ГП і пародонтоз чоловіків відрізнялися за асоціацією 0 і Rh-, яка при пародонтозі зустрічалася у 3,34 (p<0,05) раза частіше. У здорових жінок не ідентифікували двох асоціацій – АВ і Rh+ та АВ і Rh-, а у хворих на ГП виявлено всі асоціації; у разі пародонтозу були відсутні чотири асоціації: 0 і Rh-; В і Rh+; В і Rh- та АВ і Rh-. Порівняння даних, одержаних у здорових і хворих на ГП жінок, показало значну, проте недостовірну різницю за асоціаціями А і Rh- та В і Rh+. У разі пародонтозу різниця зі здоровими була вірогідною за трьома асоціаціями: А і Rh-, яка у 8,26 (p<0,05) раза частіше була у хворих; В і Rh+, що зовсім не виявлялася у хворих (p<0,05) і АВ і Rh+, якої не було у здорових (p<0,05). За чотирма асоціаціями суттєву, проте недостовірну різницю виявлено між жінками, хворими на ГП і пародонтоз. У всіх обстежених встановлено значний статевий диморфізм, особливо за асоціаціями 0 і Rh+ та АВ і Rh-. Отримані результати вказують на те, що антигени груп крові систем АВ0 і резус та їх асоціації можуть бути маркерами спадкової схильності до розвитку ГП і пародонтозу, а виявлені відмінності між хворобами є скринінг-тестами для прогнозування ризику їх розвитку і здійснення первинної профілактики (предикативної терапії).
Дослідженням ФСГ встановлено, що ГП і пародонтоз спричинені порушеннями процесів реалізації спадкової інформації, які змінюють характер і ступінь конденсації хроматину в інтерфазних ядрах букальних епітеліоцитів, що відображають експресію генів на рівні хромосом. У чоловіків це проявлялося істотним зниженням індексів ЕХ (на 28,59% і 13,12%; p<0,001), ІХ (у 2,08 і 1,54 раза; p<0,001), НІ (у 1,51 і 1,40 раза; p<0,001) та інтегрального показника ФСГ (у 8,57 і 4,88 раза), а також підвищенням вмісту СХ (у 1,84 і 1,88 раза; p<0,001) та МЗЯ (у 2,12; p<0,001 і 1,18; p>0,05 раза) при ГП і пародонтозі відповідно. У жінок спостерігали такі ж закономірності змін показників ЕХ, ІХ та МЗЯ. НІ за ГП суттєво знижувався (у 1,28 раза; p<0,01), а у разі пародонтозу – підвищувався (у 1,31 раза; p<0,05). Кількість СХ у жінок, хворих на ГП, зменшувалася у 1,30 (p<0,001) раза. Перебіг ГП не мав суттєвої залежності від структурно-функціональних показників каріограм, проте порушення трансляційно-транскрипційних взаємозв’язків зумовлювало достовірне наростання важкості ГП. Статевий диморфізм проявлявся істотнішим погіршенням ФСГ у жінок: показник МЗЯ зростав більше – у 3,57 (за ГП) і 1,39 (за пародонтозу) раза; кількість СХ у чоловіків підвищувалася, у жінок – знижувалася, досягаючи практично однакових показників у хворих на ГП ІІІ ступеня обох статей. Це свідчить про порушення механізму регуляції експресії генів і у чоловіків, і у жінок, оскільки Х-хромосома містить гени контролю реалізації біологічної інформації.
Між цитогенетичними показниками у хворих на ГП виявлено сильні і достовірні (р<0,005 – 0,001) кореляції: 7 позитивних – індекси ЕХ, ІХ, НІ між собою (r>0,99) та із СХ жінок (r>0,95) і між МЗЯ і СХ чоловіків (r>0,91); 7 негативних – показники ЕХ, ІХ, НІ із МЗЯ (r>-0,93) та із СХ чоловіків (r>-0,95), а також між МЗЯ і СХ жінок (r>-0,93). Величина пародонтальних індексів і проб та глибина ПК у хворих на ГП тісно пов’язані зі структурно-функціональними порушеннями ФСГ і мають сильні вірогідні кореляції: негативні – з ЕХ, ІХ, НІ (у різних випадках r перевищує -0,74 – -0,98; далі за текстом: r>-0,74 – -0,98) і СХ жінок (r>-0,76 – -0,93) та позитивні – з МЗЯ (r>0,79 – 0,95) і СХ чоловіків (r>0,71 – 0,93), загалом – 42.
У всіх хворих на ГП чоловіків інтегральний показник ФСГ знижувався за хронічного і загостреного перебігу: при початковому ступені – в 3,76 і 2,41; І – у 12,94 і 7,8; ІІ – у 60,38 і 53,96 раза відповідно, наближаючись до мінімальних значень за ІІІ ступеня (0,19±0,001 та 0,11±0,001 в.о. порівняно з 25,36±0,06 в.о. у здорових). При пародонтозі показник ФСГ знижувався у 4,88 раза. Отже, дослідження ФСГ вказує на порушення транскрипційно-трансляційних процесів, які достовірно корелюють зі станом пародонта. Отримані результати з вивчення генетичної обтяженості щодо ГП і пародонтозу (ДГ, асоціації з антигенами груп крові систем АВ0 і резус, ФСГ) дозволили виділити найінформативніші маркери захворювань пародонта (рис. 1).
Внутрішньоклітинні процеси зумовлені змінами генетичного апарату і мають суттєвий вплив на динаміку фізіологічних і патологічних процесів, тому фактори внутрішнього середовища – результат взаємодії генетичних і середовищних чинників в онтогенезі. Оскільки гени, які регулюють життєві функції, тісно пов’язані з МЕ гомеостазом, тому ми досліджували вміст окремих біометалів за ГП і пародонтозу. Встановлено суттєві зміни мінерального обміну. Вміст кальцію у крові хворих на ГП порівняно з даними у здорових практично не змінювався, концентрація заліза, цинку і марганцю знижувалася відповідно: на 13,87%; 26,76% і 38,25% (р<0,001), а міді – підвищувалася – в 1,16 (р<0,001) раза. Зміни у ротовій рідині були ще істотнішими. Рівень кальцію у разі ГП був більшим, ніж у здорових на 19,83% (p<0,005), заліза, цинку і марганцю – меншим відповідно: на 36,94%; 29,21% і 80,04% (р<0,001), а міді – вищим у 1,26 (р<0,001) раза. Між показниками вмісту макро- і МЕ виявлено 36 сильних достовірних кореляцій. Встановлено залежність між характером перебігу ГП і кількістю мінералів, зокрема рівня кальцію у цільній крові та кальцію і міді в ротовій рідині, який був достовірно вищим, а заліза – нижчим (лише в ротовій рідині) за загостреного перебігу (рвід<0,05 до <0,001). Отже, вказані показники можуть бути діагностичними маркерами загострення патологічного процесу в пародонті. Зміни значно поглиблювалися із наростанням важкості ГП. У хворих на пародонтоз порушення були подібними, проте вміст заліза у крові – меншим (у 1,07 раза; р<0,005), а міді – більшим (у 1,28 раза; р<0,001), ніж у хворих на ГП. У ротовій рідині рівень кальцію порівняно зі здоровими підвищувався (на 99,18%; p<0,001), а заліза, цинку і марганцю – знижувався (на 102,90%; 66,53% і 142,67%; p<0,001). Проте ці порушення були суттєво глибшими, зокрема вміст кальцію при пародонтозі був на 66,22% (p<0,001) більшим, а заліза, цинку і марганцю – відповідно на 48,17% (p<0,001); 28,88% (p=0,001) і 34,79% (p<0,005) меншим, ніж при ГП. Але найбільше обидві хвороби відрізнялися за показниками міді: за ГП він зростав у 1,26 (p<0,001) раза, а за пародонтозу – знижувався в 1,66 (p<0,001) раза. Наші дослідження підтверджують відомі дані про участь МЕ у патогенезі ГП (Горбачова И.А., Кирсанов А.И., Орехова Л.Ю., 2003), і показують, що не менш істотні, але дещо інші порушення відбуваються з МЕ обміном у випадку пародонтозу. Виявлені відмінності між цими хворобами можуть використовуватися для їх диференційної діагностики.
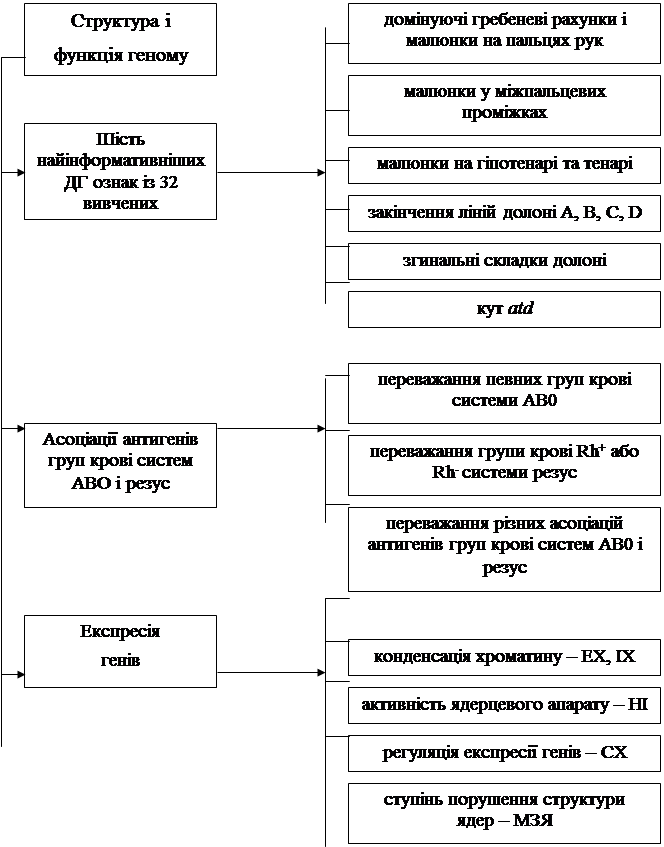
Рис. 1. Схема взаємозв’язків між маркерами генетичної схильності до генералізованого пародонтиту і пародонтозу.
Вміст біометалів у хворих на ГП має сильні достовірні взаємозв’язки із клінічними показниками: більшість із них (крім проби Ш-П) зворотно корелюють із рівнем заліза, марганцю і цинку у крові та ротовій рідині, а прямо – із кількістю кальцію у ротовій рідині та міді у крові і ротовій рідині. Показник проби Ш-П негативно корелює лише із вмістом марганцю у ротовій рідині. Загалом налічувалося 37 негативних і 18 позитивних сильних вірогідних кореляцій. Нами виявлено сильні кореляції між показниками ФСГ і МЕ у хворих на ГП, а саме: тісні позитивні кореляції індексів ЕХ, ІХ , НІ та СХ жінок із вмістом заліза, марганцю і цинку у крові і ротовій рідині та негативні – з рівнем кальцію у ротовій рідині і міді в обох рідинах. Індекси МЗЯ і СХ чоловіків, навпаки, мають сильні позитивні кореляції із вмістом кальцію у ротовій рідині, кількістю міді у крові і ротовій рідині та негативні – з рівнем заліза, марганцю і цинку в обох біологічних рідинах. Всього виявлено 27 прямих і 18 зворотних взаємозв’язків. Результати кореляційного аналізу між мінеральним складом і показниками ФСГ вказують на наявність у хворих на ГП достовірних взаємозв’язків між різними ланками метаболізму.
МЕ беруть участь у ферментативних реакціях організму, тому ми досліджували активність спряжених з ними металоферментів – каталази, ТФ і ЦП у сироватці крові. У хворих на ГП знижувалася активність каталази (в 1,17 раза; р<0,001), насиченість ТФ залізом (на 15,98%; р<0,001) і зростала активність ЦП (у 1,22 раза; р<0,001), а зміни не залежали від перебігу, проте зі збільшенням ступеня ГП вони послідовно поглиблювалися. У хворих на пародонтоз активність каталази знижувалася незначно, насиченість ТФ залізом – на 26,45% (р<0,001), а активність ЦП зростала у 1,13 (р<0,001) раза. Виявлено достовірну відмінність між ГП і пародонтозом за показниками активності каталази, ЦП та насиченості ТФ залізом, які відрізнялися відповідно в 1,11; 1,08 і 1,09 (р<0,05) раза, що може бути використано для їх диференційної діагностики. Отже, суттєві порушення активності металоферментів, встановлені нами, вказують на значне виснаження антиоксидантної системи та засвідчують їх участь у патогенетичних механізмах розвитку ГП і пародонтоз. Для детальнішої оцінки гомеостазу вивчалися
8-09-2015, 19:39
