Регуляторна роль іонів кальцію у пероксидації ліпідів і функціонуванні антиоксидантної системи. Для визначення залежності Са2+, Мg2+-АТФазної, ГП-, ГР-, ГТ-ої активностей від концентрації Са2+, його вносили у вигляді СаСl2 в інкубаційне середовище у концентраціях 0,01 мМ...2 мМ. Як контроль використовували проби без додавання Са2+.
Інтенсивність ПОЛ оцінювали за вмістом одного з кінцевих метаболітів - малонового діальдегіду (МДА). Згідно з результатами досліджень, вміст МДА зростав від 228,3±12,5 нмоль/мг білка, у контрольних пробах, до 365,2±18,1 нмоль/мг білка, за наявності 0,5 мМ Са2+.
ГП-а активність лінійно зростала із підвищенням концентрації Са2+ до 0,01 мМ і сягала 340,1±18,5 нмоль GSН (хв · мг білка) - 1 (рис.1).
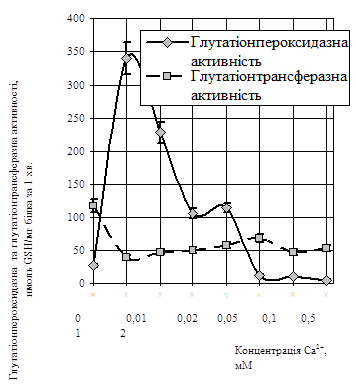 |
Рис.1. Вплив різних концентрацій Са2+ на глутатіонпероксидазну і глутатіонтрансферазну активності у лімфоцитах периферичної крові (М±m, n=15).
Більші концентрації Са2+ (0,05 мМ) зумовлювали зниження ГП-ої активності до 120,0±10,0 нмоль GSН (хв · мг білка) - 1. За наявності 0,1 мМ Са2+ у середовищі інкубації спостерігався незначний пік зростання ГП-ої активності до 134,5±10,4 нмоль GSH (хв мг білка) - 1. Більші концентрації Са2+ спричиняли інгібування активності даного ферменту.
Додавання Са2+ у середовище інкубації пригнічувало ГТ-у активність. Цей показник був найбільшим за відсутності Са2+, тобто у контрольних зразках, де він становив 117,1±10,1 нмоль GSH (хв · мг білка) - 1. Концентрації Са2+ 0,1...2 мМ зумовлювали зниження активності ферменту до 46,4±3,5 нмоль GSH (хв · мг білка) - 1 (р < 0,05) (рис.1).
ГР-а активність при 0,01 мМ Са2+ виявляла тенденцію до зниження, порівняно з контролем 24,9±3,1 нмоль NADРН (хв · мг білка) - 1, до 20,0±1,6 нмоль NADРН (хв мг білка) - 1. Із підвищенням концентрації Са2+ до 0,1 мМ спостерігалось зростання ГР-ої активності до 60,1±6,6 нмоль NADРН (хв · мг білка) - 1. Подальше збільшення вмісту Са2+ призводило до зниження активності даного ферменту.
Виявлену залежність активності ферментів глутатіонової АОС від вмісту Са2+ у середовищі можна пояснити з одного боку зростанням інтенсивності ПОЛ, а з другого - активацією власне Са2+-транспортувальних систем.
Отже, катіони Са2+ здатні регулювати процес ПОЛ та функціонування системи знешкодження наслідків його дії, здійснюючи не тільки стимулюючий вплив на глутатіонову АОС при низьких концентраціях (0,01 мМ...0,1 мМ), а й інгібувальний вплив при вищих концентраціях Са2+.
У результаті вивчення процесу гідролізу АТФ Са2+, Мg2+-АТФазою лімфоцитів було показано, що активність цього ферменту лінійно зростає із підвищенням концентрації Са2+ до 0,1 мМ і сягає 2,41±0,11 мкмоль Фн (хв · мг білка) - 1. Стосовно контролю активність ферменту зростала у 3,5 рази. Більші концентрації Са2+ призводили до зниження Са2+, Мg2+-АТФазної активності.
Продемонстрований нами вплив Са2+ на перебіг процесів ПОЛ та функціонування ферментів глутатіонової системи, ймовірно, полягає у збільшенні проникності плазматичної мембрани лімфоцитів для Са2+ внаслідок модифікуючого впливу ПОЛ, індукованого мілімолярними концентраціями власне Са2+. Підвищення в'язкості клітинних мембран внаслідок ПОЛ призводить до пригнічення роботи ферментативних систем, що виводять Са2+ з клітин, а отже концентрація Са2+ у клітині зростає та розвивається оксидативний стрес.
Зміни властивостей глутатіонової антиоксидантної системи і транспортувальних АТФаз при дії фамотидину. Відомо, що одним з основних „пускових механізмів” розвитку виразки шлунку, панкреатитів є вплив стресових чинників на організм (Циммерман Я.С., 2000).
На даний час накопичилось багато даних про інтенсифікацію процесів ПОЛ у патогенезі виразок різного походження. Посилення процесів вільнорадикального окиснення у мембранах клітин СОШ призводить до пошкодження їх структури. У процесі пероксидації ліпідів вільні радикали ушкоджують основні біомолекули (нуклеїнові кислоти, білки, ліпіди, вуглеводи) (Sohal R. S. et all., 1989).
Парієтальні клітини СОШ продукують хлоридну кислоту, яка відноситься до агресивних факторів, тому дослідження стану вільнорадикального окиснення у цих клітинах є досить актуальним. Одним із основних регуляторів функціонування парієтальних клітин є гістамін, що реалізує свою дію через Н2-рецептори. Однак, у лімфоцитах теж експресуються гістамінові рецептори. Тому можна припустити, що з метою вивчення механізму дії агоністів чи антагоністів гістамінових рецепторів можна використовувати лімфоцити периферичної крові.
У результаті проведених досліджень було виявлено, що гістамін активує ПОЛ. Вміст МДА при цьому зростає на 16%, з 226,4 ± 20,3 до 262,2 ± 22,1 нмоль/мг білка, а вміст МДА, індукованого адріаміцином, зростає на 31%, з 343,8 ± 29, 4 до 449, 5 ± 38,9 нмоль/мг білка.
У лікуванні захворювань травної системи широко використовується фамотидин - один з найефективніших представників селективних блокаторів Н2-гістамінових рецепторів (Н2-ГР) (Хомерики С.Г., Хомерики Н.М., 2000). Фамотидин дещо знижував вміст МДА у лімфоцитах стосовно контролю, з 226,4 ± 20,3 до 191,3 ± 17,7 нмоль/мг білка. Індукований адріаміцином вміст МДА також при цьому знижувався, з 343,8 ± 29,4 до 264,2 ± 18,1 нмоль/мг білка (р < 0,05).
Отримані нами результати стосовно впливу гістаміну та фамотидину на процеси ПОЛ у лімфоцитах узгоджуються з даними, отриманими на клітинах СОШ (Bliss P. W. et all., 2001; Hung C. R., 2000; Velinov H. et all., 2001).
Результати проведених досліджень свідчать про те, що антагоніст Н2-ГР фамотидин дещо знижує рівень ПОЛ у лімфоцитах периферичної крові. Таким чином, можна зробити висновок про залучення Н2-ГР у регулювання процесів вільнорадикального окиснення. Активування Н2-ГР призводить до зростання вмісту ПОЛ, а антагоніст Н2-ГР фамотидин знижує рівень ПОЛ.
Тоді як гістамін найбільш виразно стимулює продукцію НCl парієтальними клітинами шлунку, Н2-антагоністи інгібують кислотну секрецію. Антисекреторний ефект Н2-антагоністів дозволяє застосовувати їх для лікування захворювань шлунково-кишкового тракту, причиною яких є підвищене утворення НCl та пепсину (Хомерики С.Г., Хомерики Н.М., 2000; Cooke H. J. et all., 1995).
Імовірно, що моноядерні лімфоцити периферичної крові можуть бути моделлю для вивчення механізму дії Н2-антагоністів. Оскільки каталітична активність ферментів глутатіонової АОС регулює рівень процесів вільнорадикального окиснення у клітинах, забезпечує підтримання стабільності плазматичних мембран і внутрішньоклітинних структур за умов окиснювального стресу, одним із наслідків якого є порушення Са2+ транспорту, а Са2+, Мg2+ - та Nа+, К+-АТФази прямо і посередньо беруть участь у підтриманні гомеостазу цього катіона у клітині (Костерін С.О., 2000; Carafoli E., 1991), метою даної частини роботи було дослідити вплив різних концентрацій фамотидину на активність цих ферментів у лімфоцитах крові.
Встановлено, що низькі концентрації фамотидину (10-7-10-5 М) практично не впливають на ГП-у активність, тоді як при його вмісті 10-4 М, ферментативна активність зростає до 150,6±12,5 нмоль GSН (хв · мг білка) - 1, у контрольних зразках ГП-а активність становила 119±12,5 нмоль GSН (хв · мг білка) - 1 (р < 0,05). Підвищення концентрації фамотидину до 10-3 М спричиняє зниження ГП-ої активності до 75,0±6,5 нмоль GSН (хв · мг білка) - 1.
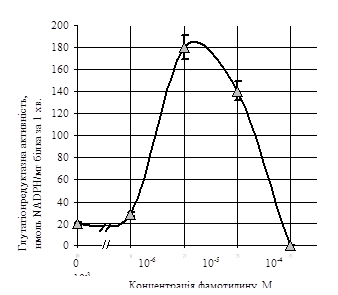 |
ГР-а активність зростала від 20,7±1,9 нмоль NADPН (хв · мг білка) - 1, за відсутності фамотидину, до 179,5±12,9 нмоль NADPН (хв · мг білка) - 1, при його концентрації 10-5 М (р < 0,05). Низькі концентрації препарату (до 10-6 М) практично не впливали на ГР-у активність. Фамотидин у концентраціях більших, ніж 10-5 М обумовлював поступове дозозалежне зниження ГР-ої активності до нульових значень (рис.2).
Рис.2. Вплив різних концентрацій фамотидину (квамателу) на глутатіонредуктазну активність лімфоцитів (М±m, n=15).
При вивченні залежності Са2+, Мg2+-АТФазної активності лімфоцитів крові людини від концентрацій фамотидину виявлено, що у контрольних пробах вона становить 1,1±0,5 мкмоль Фн (хв · мг білка) - 1. При підвищенні концентрації фамотидину в інкубаційному середовищі до 10-5 М, Са2+, Мg2+-АТФазна активність зменшувалась у 10 разів, до 0,1±0,05 мкмоль Фн (хв · мг білка) - 1. Вищі концентрації фамотидину повністю пригнічували активність даної АТФази (рис.3).
При 10-5 М концентрації фамотидину, Nа+, К+-АТФазна активність, яка у контрольних пробах становила 8,0±0,6 мкмоль Фн (хв · мг білка) - 1, пригнічувалась повністю, на відміну від Са2+, Мg2+-АТФазної активності. Нижча концентрація антагоніста (10-6 М) пригнічувала Na+, К+-АТФазну активність у 1,3 рази (р < 0,05). Активність цього ферменту залежить від ліпідного оточення, яке підлягає модифікаціям процесами ПОЛ.
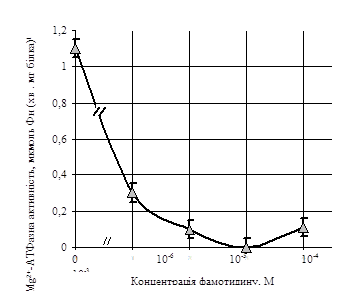 |
Рис.3. Залежність Са2+, Мg2+-АТФазної активності лімфоцитів від концентрації фамотидину (М±m, n=12).
Са2+, Мg2+-АТФази у клітинах слугують не лише одним із шляхів випомповування надлишку Са2+ із цитозоля, приймають участь у підтримуванні його низького рівня та залучені у сигнальні шляхи, але є одними із маркерів за умов патології. Відомо, що зростання концентрації іонізованого Са у цитоплазмі є одним із факторів, що беруть участь у стресових ураженнях тканин, а також при некрозних змінах на пізніх етапах розвитку виразкової хвороби. Отримані також дані про важливу роль [Са2+] і, як регулятора протонної помпи на ранніх етапах захворювання (Ashby M. S., Tepikin A. V., 2002). Тому визначення активностей АТФаз є важливим для вивчення подальших шляхів трансдукції сигналу гістамінових рецепторів.
Таким чином, нами встановлено, що Н2-ГР залучені у регулювання активності ферментів глутатіонової АОС і транспортувальних АТФаз. Встановлено антиоксидантні властивості фамотидину та продемонстровано його стимулюючий вплив на ГП - та ГР-у активності. Для АТФазних активностей засвідчено інгібувальний вплив препарату. Виявлені зміни активності Nа+, К+ - та Са2+, Мg2+-АТФаз можна пояснити як зміною ліпідного оточення, так і змінами інтенсивності ПОЛ.
Вплив блокатора М1-холінергічних рецепторів пірензепіну на активність ферментів глутатіонової антиоксидантної системи і транспортувальних АТФаз лімфоцитів крові. При пептичних виразках, ерозивних гастритах, невиразковій диспепсії, панкреатитах широко використовуються не тільки блокатори Н2-ГР (Дегтярьова I.І. і ін., 2000; Gespach C. et all., 1990; Kulkarni P. N. et all., 1997), але й блокатори М1-холінергічних рецепторів (Otsuki M. et all., 1986; Singer M. V. et all., 1991; Teyssen S. et all., 1995). Загальновизнаним у клінічній практиці М1-холінолітиком є пірензепін. Відомо, що він блокує ацетилхолінові рецептори СОШ і секреторних клітин підшлункової залози, зменшує їх функціональну активність та стимулює рівень кровоплину (Бендиков Э.А. и др., 1985; Omura N. et all., 1988; Otsuki M. et all., 1986; Singer M. V. et all., 1991; Teyssen S. et all., 1995). Відомо, що лімфоцити, як і нервові клітини, можуть активно та оперативно брати участь в індукції і регуляції стрес-реакцій організму шляхом синтезу та секреції різноманітних факторів (Давтян Т.К. и др., 2001). Лімфоцити, як і ацинарні клітини підшлункової залози, і клітини СОШ здатні експресувати різні субтипи М-холінергічних рецепторів, зокрема М1 (Bronzetti E. et all., 1996; Nomura J. et all., 2003). Можна припустити, що механізм дії інгібіторів М1 - холінорецепторів у цих клітинах подібний.
Встановлено, що вміст одного з кінцевих метаболітів ПОЛ - МДА у лімфоцитах із підвищенням концентрації пірензепіну зменшується. Тоді як із підвищенням концентрації пірензепіну вміст МДА у лімфоцитах зменшувався, активність ГП зростала із 156 ± 11 (контроль) до 189 ± 12 нмоль GSН (хв · мг білка) - 1. Пірензепін не тільки призводить до зростання активності ГП, як нами продемонстровано, але і до зростання активності супероксиддисмутази. Так, у результаті лікування хворих хронічним панкреатитом за допомогою пірензепіну, активність супероксиддисмутази у крові зростала у 2,5 рази (Дегтярьова I.І. і ін., 2000).
Оскільки функціонування ГП залежить від наявного пулу відновленого глутатіону, який забезпечується функціонуванням ГР, наступним етапом роботи було вивчення активності цього ферменту. Показано, що із підвищенням концентрації пірензепіну у пробах від 0 до 10-3 М ГР-а активність лімфоцитів збільшувалась.
За відсутності пірензепіну ГР-а активність складала 48±6 нмоль NADPH (хв · мг білка) - 1. По мірі підвищення концентрації препарату з 10-6 до 10-3 М активність зростала до 77,8±8 нмоль NADPH (хв · мг білка) - 1, виходячи на плато. Порівнюючи активності ГП і ГР при дії пірензепіну можна бачити, що ГР чутливіша до дії препарату, її активність змінюється у ширших межах.
Таким чином, отримані результати показують, що ефект пірензепіну на лімфоцити периферичної крові обумовлений не тільки його зв'язуванням із М1-холінергічними рецепторами (Nomura J. et all., 2003; Tayebati S. K. et all., 1999) і подальшою передачею сигналу через фосфатидилінозитидну систему, але і впливом на ПОЛ і глутатіонову АОС.
Отже, інгібітор М1-холінергічних рецепторів пірензепін інгібує ПОЛ та активує глутатіонову АОС лімфоцитів крові. Лімфоцити крові можна використовувати для вивчення механізмів дії препаратів, які реалізують свій ефект через мускаринові холінергічні рецептори.
При вивченні впливу пірензепіну на Са2+, Мg2+-АТФазну активність встановлено, що із підвищенням концентрації препарату активність ферменту знижується (табл.1). Са2+, Мg2+-АТФазна активність зменшувалась з 2,8±0,02 мкмоль Фн (хв · мг білка) - 1, у контрольних зразках, до 1,3±0,1 мкмоль Фн (хв · мг білка) - 1, за наявності в інкубаційному середовищі 10-3 М пірензепіну.
Na+, К+-АТФазна активність, яка у контрольних пробах становила 5,9±0,5 мкмоль Фн (хв · мг білка) - 1, пригнічувалась відповідно до підвищення концентрації пірензепіну, за 10-3 М концентрації препарата становила 0,4±0,04 мкмоль Фн (хв · мг білка) - 1. Отже, пірензепін також виявляє дозозалежний інгібувальний вплив щодо Na+, К+-АТФазної активності лімфоцитів.
Таблиця 1
Залежність АТФазних активностей лімфоцитів крові від концентрації пірензепіну (М±m)
| Концентрація пірензепіну, М | |||||
| 0 | 10-6 | 10-5 | 10-4 | 10-3 | |
| Кількість досліджень | n = 18 | n = 18 | n =18 | n = 18 | n = 18 |
Са2+, Мg2+-АТФазна активність, мкмоль Фн (хв × мг білка) - 1 |
2,8±0,1 | 1,8 ±0,2 | 1,5± 0,1 | 1,4±0,1 | 1,3±0,1 |
Na+, К+-АТФазна активність, мкмоль Фн (хв × мг білка) - 1 |
5,9±0,5 | 4,4±0,3 | 1,4±0,1 | 0,7±0,06 | 0,4 ±0,04 |
Можливо, така пригічувальна дія пірензепіну на АТФази пов'язана із антиоксидантними властивостями препарату, які вже встановлені на сьогоднішній час (Бендиков Э.А. и др., 1985; Дегтярьова I.І. і ін., 2000; Bronzetti E. et all., 1996). У дослідженнях на лімфоцитах периферичної крові людини нами засвідчено функціональний зв’язок між глутатіоновою антиоксидантною та Са2+-транспортувальною системами.
Активність ферментів глутатіонової антиоксидантної системи і транспортувальних АТФаз лімфоцитів крові при дії блокатора протонної помпи омепразолу. Відомо, що Н+, К+-АТФаза (протонна помпа) СОШ відповідає за секрецію соляної кислоти. При цьому активний транспорт іонів водню та калію здійснюється у протилежних напрямках для генерації надмірного градієнта Н+ через мембрану за фізіологічних умов (Asano S. et all., 2001; 2004).
При лікуванні широкого спектру кислотоасоційованих захворювань верхніх відділів травного тракту широко використовується блокатор протонної помпи омепразол (Заїка С.В., 2000; Burdan F. et all., 2000; Nakamura T. et all., 1995). Однак, ймовірно, механізм дії цього препарату більш широкий. Представляє інтерес вивчення його впливу на активність ферментів глутатіонової АОС, оскільки розвиток багатьох захворювань супроводжується оксидативним стресом і, відповідно, інтенсивною продукцією активних форм кисню (Барабой В.А. и др., 1997; Владимиров Ю.А., 1989).
Хоча Н+, К+-АТФаза експресується переважно у СОШ, вона також виявлена і у лімфоцитах (Bergman M. P. et all., 2003). На пермеабілізованих лімфоцитах периферичної крові нами встановлено, що із підвищенням концентрації омепразолу до 10-4 М активність ГП поступово зростає, досягаючи рівня 1,46 ± 0,1 мкмоль GSH (хв · мг білка) - 1, що в 4,8 рази вище контрольних значень (0,3 ± 0,2 мкмоль GSH (хв · мг білка) - 1). Концентрації препарату понад 10-4 М призводили до зниження активності ГП (рис.5).
Зміни активності ГР полягали у її зростанні з 0,04 ± 0,05 мкмоль NADPH (хв · мг білка) - 1, за відсутності омепразолу, до 0,22 ± 0,03 мкмоль NADPH (хв · мг білка) - 1, при його концентрації 10-4 М. При подальшому підвищенні концентрації цього препарату спостерігалось деяке зменшення активності ферменту.
Встановлено, що ефект омепразолу на активність обох АТФаз є дозозалежним. Оптимальні концентрації препарату (10-3 М) пригнічують активність Са2+, Мg2+-АТФази у 2,4 рази, з 2,8±0,1 до 1,2 ± 0,1 мкмоль Фн (хв · мг білка) - 1 (Рис.6), а активність Nа+, К+-АТФази - у 9,8 рази, з 5,9±0,5 до 0,6±0,06 мкмоль Фн (хв · мг білка) - 1.
Таким чином, у результаті виконання цієї роботи встановлено, що блокатори Н2-гістамінових рецепторів, М1-холінергічних рецепторів, протонної помпи – фамотидин, пірензепін, омепразол, відповідно, окрім основної дії, пов’язаної з їх взаємодією з відповідними рецепторами чи протонною помпою та залученням у цей процес G-білків і фосфатидилінозитидної та аденілатциклазної систем, мають і інший механізм дії. Цей механізм має не менш важливе значення, оскільки у ньому задіяна пероксидація ліпідів, ферменти глутатіонової антиоксидантної системи, іон-транспортувальні системи. Оскільки, як вказувалось вище, у лімфоцитах периферичної крові експресуються Н2-гістамінові, М1-холінергічні рецептори, Н+, К+-АТФаза, вони можуть бути адекватною та зручною моделлю для вивчення механізму дії цих чи інших блокаторів вказаних рецепторів та протонної помпи.
ВИСНОВКИ
У дисертаційній роботі, відповідно до поставленої мети та завдань дослідження, на пермеабілізованих моноядерних лімфоцитах периферичної крові людини вперше отримані дані про роль глутатіонової антиоксидантної системи і транспортувальних АТФаз у реалізації ефектів блокаторів Н2-гістамінових, М1-холінергічних
8-09-2015, 19:42
