На другому етапі дослідження, при проведенні аналізу розподілу антропологічних показників та генетичних детермінант серед фенотипів ацетилювання у цих трьох групах обстежених, виявлено: 1) у здорових осіб повільний фенотип NAT2 вірогідно частіше зустрічається у осіб з карими очима; швидкий фенотип NAT2 - достовірно частіше у сірооких (p<0,05); швидкі АЦ вірогідно мають в родинному анамнезі порушення обміну речовин (ЦД, ожиріння) (p<0,01); 2) у хворих на ІХС серед швидких АЦ вірогідно переважають хворі з прямокутними нігтями (p<0,05); швидкий фенотип NAT2 достовірно частіше зустрічали серед пацієнтів з нормальною масою тіла (p<0,05); 3) у хворих на ЦД серед швидких АЦ вірогідно збільшена частка осіб з карими очима та зменшена – з голубими, проти пацієнтів з повільним ацетиляторним статусом (p<0,05). Отже, це підкреслює наявність зв’язку між ацетиляторним статусом та антропологічними даними.
При аналізі взаємозв’язку компенсації та важкості ЦД 2 типу з ацетиляторним фенотипом, виявлено достовірне збільшення частки швидких АЦ при декомпенсації діабету (p<0,05), що може вказувати на більш агресивний перебіг ЦД у швидких АЦ. Крім того, спостерігали прямі достовірні кореляції між дозою цукрознижуючого препарату та активністю ацетилювання (r=+0,39; p<0,05), а також швидкістю збільшення дози цукрознижуючого препарату в анамнезі та характером ацетилювання (r=+0,36; p<0,05). За даними інших дослідників, по-перше, виявлено, що harmine (інгібітор моноамінооксидази) стимулює секрецію інсуліну in vitro, яка була пригнічена печінковою N-ацетилтрансферазою. Також NAT2 знайдена в острівцях Лангенгарса, що наводить на думку про наявність зв’язку між активністю NAT2 та секрецією інсуліну (W.W. Weber, 1987; S. Boukouvala, E. Sim, 2005). Гідроксильовані ароматичні та гетероциклічні аміни підлягають в подальшому ацетилюванню з утворенням ацетоксиариламінів. Ці ацетоксиефіри є досить нестійкими сполуками і розпадаються з утворенням арилнітроіонів, які викликають мутацію ДНК або загибель клітин, що може спричиняти атрофію острівців Лангенгарса (H. Ohgaki et al., 1991; F. Kelly et al., 2000; D.W. Hein et al., 2000). По-друге, оскільки біотранс-формація похідних сульфонілсечовини відбувається в основному за рахунок цитохрому CYP2C9, можливе поєднання однакових за швидкістю процесів ацетилювання та окислення (А.І. Косован, 1999). І, виходячи з цього, у пацієнтів з низькою активністю CYP2C9 можуть спостерігатись асоційовані з препаратами сульфонілсечовини гіпоглікемічні реакції (А. Holstein et al., 2005). По-третє, активність ферментів обох фаз метаболізму ксенобіотиків може фенотипово змінюватись в залежності від стану компенсації ЦД (J.A. Agendes et al., 1996).
Враховуючи важливе практичне значення швидкості ферментативного ацетилювання для оптимізації фармакотерапії, нами розроблено модель прогнозування різних варіантів ацетилювання на основі комплексу антропометричних та антропоскопічних показників:
Y=0,71-0,11ЧA+0,13ЧB+0,12ЧC-0,13ЧD+0,04ЧE-0,006ЧF+0,25ЧG-0,19Ч
H-0,16ЧI-0,2ЧJ+0,009ЧK-0,02ЧL
(R=0,40, p<0,0001; m=0,45),
де A - колір очей (1 – карий колір очей і 0 – не карий колір очей); B - форма мочки вуха (1- фіксована мочка вуха і 0 – не фіксована мочка вуха); C - розмір дистального епіфізу гомілки, см; D - наявність ямки на підборідді (1 – ямка на підборідді є; 0 – немає); E - група крові; F - обхватний розмір гомілки, см; G - товщина жирової складки на животі, см, H - товщина жирової складки під лопаткою, см; I - колір волосся (1 - брюнет і 0 – не брюнет); J - товщина жирової складки на передпліччі, см; K - обхватні розміри грудної клітки на видоху, см; L - обхватні розміри плеча, см; Y – вихідний параметр моделі, який характеризував тип ацетилювання.
На основі отриманої моделі багатофакторної лінійної регресії повільний тип ацетилювання слід очікувати у брюнетів із карими очима, не фіксованою мочкою вуха і наявністю ямки на підборідді, з І і ІІ групою крові; швидкий тип ацетилювання слід очікувати у осіб - не брюнетів, які не мають карий колір очей, з фіксованою мочкою вуха і без ямки на підборідді, з ІІІ і ІV групою крові. В свою чергу, повільному типу ацетилювання сприяють збільшення обхватних розмірів гомілки і плеча, товщини жирової складки під лопаткою і на передпліччі та зменшення розміру дистального епіфізу гомілки, обхватного розміру грудної клітки і товщини жирової складки на животі, і навпаки - при швидкому типі ацетилювання.
Для спрощення методики визначення ацетиляторного фенотипу через зменшення кількості показників була розроблена бальна шкала прогнозування характеру ацетилювання за допомогою 6 незалежних антропологічних чинників. Мінімальна кількість балів, яка могла визначатись згідно шкали, склала 0 і максимальна – 19 балів (табл. 1).
Таблиця 1. Критичні величини незалежних чинників при різних варіантах фенотипів ацетилювання
| Незалежні чинники | Бали | Критичні величини | |
| повільні АЦ | швидкі АЦ | ||
| Розмір дистального епіфізу гомілки, см | 2 | < 6,5 | > 6,5 |
| Товщина жирової складки на животі, см | 5 | < 2,1 | > 2,0 |
| Tовщинa жирової складки під лопаткою, см | 3 | > 2,0 | < 1,7 |
| Колір волосся | 2 | Брюнет | Не брюнет |
| Oбхватні розміри грудної клітки на видоху, см | 4 | < 99 | > 102 |
| Oбхватні розміри плеча, см | 3 | > 33 | < 33 |
Згідно розробленої шкали, повільний тип ацетилювання слід було передбачити у хворих-брюнетів, із розміром дистального епіфізу гомілки менше 6,5 см, товщиною жирової складки на животі менше 2,1 см і під лопат-кою більше 2,0 см, обхватних розмірах грудної клітки на видоху менше 99 см і обхватних розмірах плеча більше 33 см, і навпаки у швидких АЦ. При прогнозуванні повільного типу ацетилювання і наявності 2 балів має місце 100% специфічність прогнозу. Найбільшу чутливість (55-58%) прогнозування повільного типу ацетилювання визначали при наявності від 6 до 11 балів. Досить висока (65% і вище) чутливість прогнозування швидкого типу ацетилювання спостерігається при наявності 12 і більше балів. При наявності 15 балів чутливість набуває 100%.
Отримані нами дані можна пояснити наступним чином: 1) тісні асоціації із деякими антропологічними показниками та групою крові підтверджують генетич-но обумовлену направленість характеру ацетилювання; 2) експресія та пригнічен-ня генів пов’язані з ремоделюванням структури хроматину ферментативними перетвореннями ядерних гістонів, особливо завдяки ацетилюванню; глюкокорти-коїди зв’язуються з глюкокортикоїдними рецепторами в цитоплазмі, які, в свою чергу, через кофактори (CBP та pCAF) активують ацетилювання та транскрипцію генів, і, таким чином, реалізуються ефекти глюкокортикоїдів (P.J. Barnes, 2006); при зниженій активності ацетилтрансферази, зменшується ліпогенез, відбувається активація соматотропного гормону та мелатоніну.
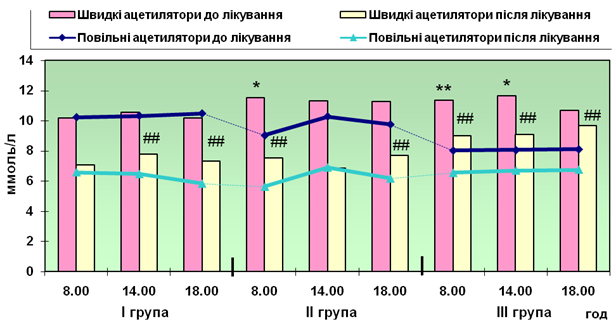
Примітки: *, ** - достовірна різниця глікемії до лікування між повільними та швидкими АЦ (р<0,05; р<0,01, відповідно); #, ## - достовірна різниця глікемії після лікування між повільними та швидкими АЦ (р<0,05; р<0,01, відповідно).
Рис. 1. Динаміка глікемії при застосуванні глімепіриду.
Клінічне дослідження ефективності та безпеки комплексної фармакотерапії 96 хворих на ЦД 2 типу в поєднанні чи без ІХС виявило достовірне зниження рівня цукру крові та глікованого гемоглобіну (на 19,52% в групі глімепіриду, 20,06% в групі глімепіриду з тіотриазоліном та на 18,53% - глімепіриду з тіотриазоліном та ловастатином), без вірогідних відмінностей між групами. При цьому динаміка глікемії під впливом глімепіриду виявилась кращою серед повільних ацетиляторів.
При аналізі ефективності базової терапії ІХС було виявлено достовірне зниження частоти нападів стенокардії та кількості таблеток нітрогліцерину за добу на тлі базової терапії з глімепіридом (Г) на 35,81% та 31,46%, відповідно, а також в групі глімепірид+тіотриазолін (Г+Т) на 43,64% та 43,6%, відповідно, та на 56,91% і 53,89% - в групі глімепірид+ тіотриазолін+ловастатин (Г+Т+Л), причому в останній групі цей вплив був більш значимим (p<0,05).
За даними ехокардіографії на тлі застосування комплексної терапії визначалось достовірне (p<0,05) зменшення величини передньо-заднього розміру лівого передсердя (на 8,35±1,76%, 6,47±0,51% та 7,4±1,15%, відповідно в 1-й, 2-й та 3-й групах), відношення розміру лівого передсердя до кінцево-діастолічного розміру лівого шлуночка (на 8,79±2,11%, 8,51±0,81% та 6,69±3,03%, відповідно), а також збільшення фракції викиду (на 9,99±1,55% та 9,14±1,68%, відповідно в групах Г+Т та Г+Т+Л), при цьому в 2-й групі ці зміни відбувались переважно за рахунок повільних АЦ. За даними ЕКГ-моніторингу виявлено достовірне зменшення середньої кількості (на 52,67±6,64%, 59,7±5,52% та 62,64±5,93%, відповідно, в 1-й, 2-й та 3-й групах) і тривалості (на 51,84±7,94%, 59,99±5,22% та 73,35±5,01%, відповідно) епізодів ішемії та тривалості епізодів безбольової ішемії (на 43±9,21% та 67,31±6,98%, відповідно в групах Г+Т та Г+Т+Л), проте цей ефект був достовірно більшим в групі Г+Т+Л (p<0,05).
При оцінці впливу трьох варіантів терапії на ліпідний спектр крові лише в групі Г+Т+Л на тлі високих початкових рівнів гіперхолестеринемії (ЗагХС – 7,16±0,15 ммоль/л проти 5,37±0,16 ммоль/л в групі Г та 5,85±0,12 ммоль/л при терапії Г+Т; ХС ЛПНЩ – 5,28±0,19 ммоль/л проти 3,63±0,14 ммоль/л в групі Г та 4±0,16 ммоль/л при терапії Г+Т) було отримано найбільший ефект від гіполіпідемічної терапії – достовірне зниження рівнів усіх показників ліпідного спектру та збільшення ХС ЛПВЩ (рис. 2 і 3). При цьому зниження рівнів МДА, ІА та ХС ЛПНЩ відбувалась за рахунок повільних АЦ.
При обстеженні 42 практично здорових осіб, середній вік яких був 38±1,49 років, контрольний рівень нітратів та нітритів крові становив 0,47±0,03 та 0,16±0,02 мкг/мл, відповідно. У хворих відмічалось зниження як рівня нітратів (p<0,001), так і нітритів (p<0,05) до початку фармакотерапії проти контрольної групи. Під впливом лікування відмічали достовірне збільшення нітритів та нітратів крові лише в групі Г+Т+Л, хоча відмічено вірогідний приріст нітратів та загального вмісту метаболітів NO крові при терапії Г+Т (рис. 4), що також відбувалось переважно за рахунок повільних АЦ.
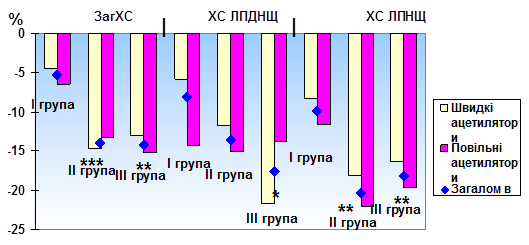
Примітки для рис. 2 і 3: * - достовірна динаміка показників для групи загалом (p<0,05); ** - достовірна динаміка показників для групи загалом (p<0,01); *** - достовірна динаміка показників для групи загалом (p<0,001).
Рис. 2. Динаміка ліпідного спектру крові при різних варіантах терапії ІХС з ЦД 2 типу в залежності від ацетиляторного статусу (у %).
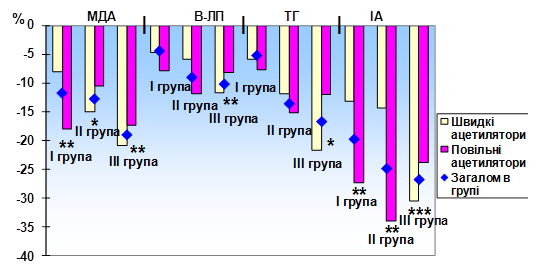
Рис. 3. Динаміка МДА та ліпідного спектру крові при різних варіантах терапії ІХС з ЦД 2 типу в залежності від ацетиляторного статусу (у%).
Примітки до рис. 4-5: * - p<0,05 між показниками до та після лікування; ** - p<0,01 між показниками до та після лікування; *** - p<0,001 між показниками до та після лікування.
Рис. 4. Динаміка нітратів та нітритів крові при різних варіантах терапії ІХС з ЦД 2 типу (у %).
Аналіз кореляційних зв’язків між рівнем показників ліпідного спектру та нітратів і нітритів крові виявив: достовірні негативні кореляції між рівнем нітритів і такими показниками, як вік, ЗагХС, в-ЛП та МДА (p<0,05); достовірні негативні кореляції між рівнем нітратів та ЗагХС, в-ЛП, ТГ, ХС ЛПДНЩ, ХС ЛПНЩ та індексом атерогенності (p<0,05). Дані кореляційної матриці підтверджують патогенетичний взаємозв’язок між станом ліпідного обміну та метаболітами NO, як показниками ендотеліальної дисфункції.
Нами виявлено достовірне зниження частки N-ацетилсульфадимезину серед обох фенотипів ацетилювання та вірогідне зменшення екскреції загального та ацетильованого сульфадимезину, в основному за рахунок останнього та переважно серед повільних АЦ, особливо в групах Г+Т та Г+Т+Л (рис. 5), що свідчить про інгібуючий вплив тіотриазоліну на активність NAT2. Такий результат є неоднозначним для комплексної фармакотерапії препаратами, що метаболізуються за допомогою NAT2, і повинен враховуватись практичними лікарями у виборі тактики поєднання лікарських засобів.
Рис. 5. Динаміка середнього вмісту N-ацетилсульфадимезину в сечі при різних варіантах терапії в залежності від ацетиляторного статусу (у %).
Таким чином, проведені дослідження довели ефективність комплексного застосування глімепіриду з тіотриазоліном та ловастатином у хворих на ІХС в поєднанні з ЦД 2 типу.
ВИСНОВКИ
В дисертації теоретично та клінічно доведено доцільність використання тіотриазоліну та ловастатину для підвищення ефективності фармакотерапії ІХС в поєднанні з ЦД 2 типу глімепіридом з урахуванням поліморфізму NАТ2.
1. У хворих на ІХС у поєднанні з ЦД 2 типу ацетилювання сульфади-мезину характеризується бімодальним поліморфізмом. Кількісне співвідно-шення між фенотипами повільних та швидких АЦ при ЦД 2 типу (54,8%; 45,2%, відповідно) не відрізняється від бімодального співвідношення у здорових осіб (56%; 44%, відповідно) та у хворих на ІХС (44,2%; 55,8%, відповідно) і співпадає з встановленим для європейської популяції.
2. На моделі багатофакторної регресії та шкалі прогнозування фенотипу ацетилювання виявлено асоціативні зв’язки активності NАТ2 з антропологічними показниками. Швидкий фенотип NAT2 є чинником розвитку резистентності до фармакотерапії цукрознижуючими препаратами з групи сульфонілсечовини.
3. У повільних АЦ хворих на ІХС в поєднанні з ЦД 2 типу під впливом глімепіриду відзначено достовірне зниження рівнів цукру крові (з 10,49± 0,45 до 5,84±0,38 ммоль/л в 18.00 в 1-ій групі; з 9,03±0,55 до 7,16±0,41 ммоль/л в 8.00 в 2-ій групі; з 9,01±0,47 до 6,56±0,41 ммоль/л в 8.00 та з 9,65±0,37 до 6,77±0,34 ммоль/л в 18.00 в третій групі), в більшій мірі ніж серед швидких.
4. Під впливом глімепіриду у хворих на ІХС з ЦД 2 типу відмічено достовірне зменшення кількості нападів стенокардії та частоти застосування таблеток нітрогліцерину (на 35,81% та 31,46%, відповідно); достовірне зменшення величини передньо-заднього розміру ЛП (-8,35±1,76%), відношення розміру ЛП/КДР (-8,79±2,11%); зменшення кількості та тривалості епізодів ішемії міокарду (на 52,67±6,64% та 51,84±7,94%, відповідно). Відмічається достовірне зниження МДА та ІА (на 11,74±2,08% та 19,78±4,35%, відповідно). При цьому серед повільних АЦ відмічено достовірне зменшення середньої кількості нападів стенокардії за добу, середньої кількості епізодів та тривалості ішемії (р<0,05), а також зниження рівня МДА та ІА (р<0,01); у швидких – лише зменшення середньої частоти застосування таблеток нітрогліцерину на добу (р<0,05).
5. При поєднаному застосуванні глімепіриду та тіотриазоліну протягом двох місяців у хворих на ІХС в поєднанні з ЦД 2 типу, окрім перерахованих змін в першій групі, спостерігається: достовірне збільшення ФВ (на 9,99±1,55%) та зменшення тривалості безбольової ішемії міокарду (на 43,0±9,21%); достовірне зниження рівнів ЗагХС, ХС ЛПНЩ, а також збільшення рівнів нітратів крові та загального вмісту метаболітів NO (на 41,72±13,06% та 39,82±9,71%, відповідно). Серед повільних АЦ відмічається достовірне збільшення загального вмісту метаболітів NO (р<0,01) та нітратів крові (р<0,05), у швидких - зменшення величини передньо-заднього розміру ЛП та рівня МДА (р<0,05).
6. При комплексній фармакотерапії ІХС та ЦД 2 типу глімепіридом, тіотриазоліном та ловастатином в порівнянні з 1-ою та 2-ою групами відмічається достовірно вагоміший вплив на наступні показники: зменшення кількості нападів стенокардії та частоти застосування таблеток нітрогліцерину (на 56,91% та 53,78%, відповідно); зменшення кількості та тривалості епізодів ішемії міокарду (на 62,64±5,93% та 73,35±5,01%, відповідно), а також тривалості безбольової ішемії міокарду (на 67,31±6,98%). Крім того, при високих початкових показниках гіперхолестеринемії відбувається достовірне зниження усіх атерогенних складових ліпідного спектру крові і збільшення рівня ХС ЛПВЩ, підвищення рівнів нітритів і нітратів крові (на 46,15±8,76% та 55,22±6,17%, відповідно). При цьому серед повільних АЦ виявлено достовірне зменшення відношення ЛП/КДР, збільшення ФВ та зменшення рівня ХС ЛПНЩ (р<0,05). Достовірна динаміка величини передньо-заднього розміру ЛП, середньої тривалості епізодів ішемії, рівнів МДА, ЗагХС, в-ЛП, ТГ та ХС ЛПДНЩ, ІА, нітратів та нітритів крові (р<0,05 та р<0,01) відбувається за рахунок обох ацетиляторних фенотипів, де також спостерігали вагоміший внесок саме повільних АЦ.
7. Встановлено вплив тіотриазоліну на фермент ІІ фази біотрансфор-мації ліків – NAT2: виявлено пригнічуючий ефект тіотриазоліну на екскрецію загального (на 17–28%) та ацетильованого сульфадимезину (на 22–60%) та вміст N-ацетилсульфадимезину в сечі у хворих на ЦД 2 типу, як у повільних, так і швидких АЦ, але цей вплив був найбільшим для повільного фенотипу ацетилювання.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Для цілеспрямованого вибору препаратів при лікуванні пацієнтів слід проводити фармакологічне тестування з сульфадимезином або математичне визначення фенотипу ацетилювання за допомогою прогностичної моделі чи шкали за даними антропометрії.
2. Комплексна фармакотерапія глімепіридом (в індивідуально ефективній дозі 1-8 мг/добу), тіотриазоліном (перші 10 днів в/м по 2 мл 2,5% розчину, двічі на добу, в подальшому - перорально по 200 мг 3 рази/ добу, протягом 2 місяців) та ловастатином (у дозі 20 мг/добу протягом 2 місяців) є оптимальним варіантом для лікування ІХС та ЦД 2 типу, особливо у повільних ацетиляторів.
3. В клінічній практиці необхідно враховувати здатність тіотриазоліну гальмувати екскрецію сульфадимезину як маркера активності N-ацетилтрансферази-2, що вимагає контролю при комбінації його з іншими лікарськими засобами, які ацетилюються.
ПЕРЕЛІК РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Дорошкевич І.О., Яковлева О.О., Власенко М.В. Фармакоепідеміологія та фармакогенетичні аспекти N-ацетилтрансферази при цукровому діабеті // Український терапевтичний журнал. – 2005. - № 1. – С. 51-56. (дисертант створила протокол та провела дослідження, проаналізувала результати визначення ацетиляторного поліморфізму у хворих на цукровий діабет,
8-09-2015, 20:06
