Як видно, при низьких концентраціях іонів Са2+ в середовищі агрегація тромбоцитів практично не відбувається, що може вказувати на позаклітинну природу кальцію, що бере участь у процесі агрегації.
Крім того, наведені дані свідчать, що у безкальцієвому середовищі іони Мg2+ можуть заміщати собою іони Са2+ в ролі кофактору процесу агрегації тромбоцитів.
Табл..2.
Вплив іонів Са2+ і Мg2+ на ступінь (∆D) і швидкість (V) агрегації тромбоцитів
| Са2+ | Мg2+ | ||
| Концентрація, mM | ∆D, o.о. | Концентрація, mM | V, о.о./хв. |
| 0,10 | 0,02 ± 0,015 | 0,1 | 0,42± 0,046 |
| 0,25 | 0,04 ± 0,021 | 0,5 | 0,67± 0,085*, ** |
| 0,50 | 0,09± 0,033 | 1,0 | 0,89± 0,107*, ** |
| 0,75 | 0,19± 0,041*, ** | 2,0 | 1,21± 0,131*, ** |
| 1,0 | 0,30± 0,052*, ** | 5,0 | 1,46± 0,142*, ** |
| 1,50 | 0,37 ± 0,056* | 10,0 | 1,62± 0,148* |
| 2,0 | 0,49± 0,070*, ** | 15,0 | 1,58± 0,139* |
| 3,0 | 0,51± 0,071* | 20,0 | 1,64± 0,150* |
| 4,0 | 0,48± 0,068* | 25,0 | 1,64± 0,150* |
Примітка:* - вірогідно відносно мінімальної концентрації Са2+ і Мg2+ (р < 0,05)
** - вірогідно відносно попередньної концентрації Са2+ і Мg2+ (р < 0,05)
Для з’ясування ролі іонів Са2+ і Мg2+ у взаємодії граміцидину S з інтактними тромбоцитами було проведено дослідження їх агрегації у ЗТП, з якої за допомогою ЕДТА були вилучені іони обох елементів.
На Рис.2 зображені кінетичні криві світлопропускання ЗТП в цих умовах на початкових стадіях зміни форми і активації тромбоцитів. Згідно з цими кривими, при зниженні концентрації Са2+ і Мg2+ в середовищі зміна форми клітин стає менш складною і при повній відсутності обох іонів вони, не активуючись, лише набрякають.
Цей результат підтверджує те, що граміцидин S у концентрації, коли кількість його молекул, що припадають на один тромбоцит, нижче критичної, діє, як типовий індуктор агрегації.
Дослідження впливу граміцидину S на АДФ-індуковану агрегацію тромбоцитів.
На рис.3 зображені часові залежності світлопропускання ЗТП за послідовною дією АДФ і граміцидину S, зіставлені з фотографіями ЗТП на різних стадіях процесу. Додавання граміцидину S до тромбоцитів після завершення АДФ-індукованої агрегації викликає зменшення світлопропускання зразка. Це зменшення, як видно з фотографій, являє собою розпад агрегатів, що утворилися
Хоча механізм руйнування тромбоцитарних агрегатів остаточно ще не з’ясований, можна, однак, припустити таке.
Молекулиграміцидину S, вбудовуючись у мембрану, порушують ліпід-ліпідні й ліпід-білкові взаємодії й, імовірно, викликають в мембрані пружне напруження. Міцність білкових містків, що з'єднують тромбоцити в агрегаті, є набагато меншою міцності мембрани, позаяк в ній діють великі гідрофобні сили [Овчинников Ю.А.,1987 ].
Тому напруга, викликана вбудовуванням молекул антибіотика у мембрану, може зніматися за рахунок розривів саме білкових (фібриногенових) містків. При розриві цих зв'язків агрегати будуть розпадатися, при цьому кількість центрів, що розсіюють світло, збільшується, що приводить до зменшення світлопропускання зразка
АДФ; 4 – 5 хвилин після додавання граміцидину S. Концентрація граміцидину S – 4,15 мкмоль/л.
Зв'язування граміцидину S з мембраною клітини є динамічним процесом, який складається з кількох стадій і включає електростатичні – за участю іонів Са2+ й гідрофобні взаємодії з різними хімічними групами мембрани тромбоцитів. Природно, що процеси взаємодії антибіотика з мембранами індивідуальних тромбоцитів і тих, які знаходяться у складі агрегатів, повинні відрізнятись і мати свої особливості. Для з’ясування цих особливостей були виміряні ступінь і швидкість дезагрегації тромбоцитів в залежності від концентрації граміцидину S. Отримані дані наведені в Табл..3.
Як і припускалося, і ступінь і швидкість дезагрегації тромбоцитів за дією граміцидину S зростають з підвищенням його концентрації. Більш цікавим є те, що руйнування тромбоцитарних агрегатів відбувається вже при концентрації антибіотика 8,6 Ч 105 молекул у розрахунку на одну клітину. Це на півтора порядки менше молекул граміцидину S, ніж їх кількість, при котрій починають руйнуватися індивідуальні клітини - (14,94 - 18,79) Ч106 , Табл..1.
Така суттєва різниця може бути наслідком того, що при утворенні агрегатів на мембрані клітин, що входять до їх складу, з’являються ділянки з більшою спорідненістю до антибіотика і меншою механічною міцністю
Табл..3
Концентраційні залежності ступеня і швидкості дезагрерації тромбоцитів при дії граміцидину S
| Показник | Концентрація граміцидину S, мкмоль/л | |||
| 2,07 | 4,15 | 8,30 | 16,60 | |
Кількість молекул граміцидину S/ тромбоцит Ч106 |
4,81 ± 0,217 | 9,23 ± 0,341 |
19,92 ± 1,248 |
39,84 ± 2,691 |
| Ступінь дезагрегації тромбоцитів після додавання граміцидину S - ∆Т, % | 8,4 ± 2,15 |
33,3*, ** ± 3,713 |
46,7*, ** ± 4,066 |
71,7*, ** ± 5,810 |
| Швидкість дезагрегації тромбоцитів після додавання граміцидину S - ∆Т % / хв | 1,9 ± 0,13 |
3,4*, ** ± 0,29 |
4,8*, ** ± 0,612 |
7,3*, ** ± 0,732 |
Примітка:* - вірогідно відносно мінімальної концентрації граміцидину S (р < 0,05)
** - вірогідно відносно попередньої концентрації граміцидину S (р < 0,05)
Дослідження впливу граміцидину S на АДФ-індуковану агрегацію тромбоцитів при дії фізичних і хімічних чинників.
В основі взаємодії граміцидину S з мембранами клітин лежать, по суті, хімічні реакції утворення зв’язків між амінокіслотними залишками антибіотика і реакційноспроможними групами ліпідів [Егоров Н.С.,1994]. Не кажучи вже про те, що і хімічні реакції і рухливість ліпідів є температурнозалежними, в області від кімнатної до теиператури тіла мембранні ліпіди зазнають фазових структурних переходів, які змінюють їх реакційні властивості [Оічинников Ю.А.,1987].
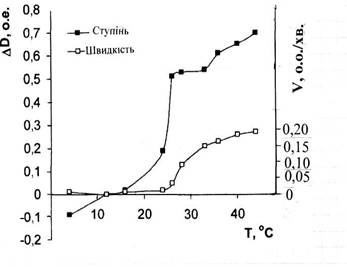
Рис. 4. Температурні залежності ступеня (∆D) і швидкості (V) розпаду агрегатів тромбоцитів при дії граміцидину S.
Тому в цій області слід чекати особливостей у характері взаємодії антибіотика з тромбоцитами.
На рис. 4 приведені температурні залежності оптичних параметрів ЗТП, які відображають і ступінь і швидкість руйнування тромбоцитарних агрегатів в області температур структурних переходів ліпілів.
Як видно, крім звичайного зростання величини обох досліджених параметрів з температурою, в области t = 180 С – 330 С спостерігається різкий скачок підвищення ступеня і швидкості руйнування тромбоцитарних агрегатів під дією граміцидину S. В цій області величини обох параметрів дезагрегації стають максимальними. При подальшому рості температури це підвищення стає повільнішим, що свідчить про більшу стійкість агрегатів до дії антибіотика при температурі тіла.
Виявлені особливості свідчать, що характер зв’язування граміцидину S з клітинними мембранами в значній мірі залежить від їх структурного стану. Для більш глибокого з’ясування цього явища були вивчені температурні залежності ступеня і швидкості дезагрегації тромбоцитів під дією антибіотика після їх г-опромінення і індукції в мембранах ПОЛ. Отримані дані представлені в Табл.4 і Табл.5.
г-опромінення тромбоцитів в областівивчених температур дозою 2,58 Кл/кг Ч 10-4 приводитьдо підвищення, а дозою 6,54 Кл/кг Ч 10-3 – до зниження ступеня і швидкості дезагрегації тромбоцитів, причому величина ціх змін росте с температурою. Ця різниця в дії використаних доз, очевидно, є наслідком того, що малі дози випромінювання частково руйнують біополімери мембран, розпорядковуючи, таким чином, їх структуру і, відповідно, механічну міцність. Під впливом же великих доз біополімери можуть зшиватися між собою, підвищуючи тим самим механічні властивості мембран [ ВеnderittM. etal., 1999 ].
Табл..4.
Вплив г-опромінення на температурну залежність ступеня (ДD) та швидкості (V) дезагрегації тромбоцитів при дії граміцидину S
| Показник | Умови експерименту |
Доза oпромінення, Кл/кг Ч 10-4 |
Т0 , С | ||
| 20 | 25 | 30 | |||
| ДD, o.o. | Контроль | - | 0,11 ± 0,031 |
0,23** ± 0,042 |
0,47** ± 0,096 |
| Опромінення | 2,58 | 0,05* ± 0,017 |
0,73*, ** ± 0,118 |
15,27*, ** ± 2,72 |
|
| 64,50 | 0,08 ± 0,021 |
0,14 ± 0,038 |
6,58*, ** ± 1,83 |
||
| V, о.о./хв | Контроль | - | 0,011 ± 0,031 |
0,023** ± 0,042 |
0,12** ± 0,029 |
| Опромінення | 2,58 | 0,007* ± 0,002 |
0,064*, ** ± 0,019 |
4,22*, ** ±1,38 |
|
| 64,50 | 0,012 ± 0,028 |
0,012* ± 0,031 |
2,94*, ** ± 0,75 |
||
Примітка:* - вірогідно відносно контролю (р < 0,05)
** - вірогідно відносно попередньої температури (р < 0,05)
Індукція ПОЛ в мембранах тромбоцитів значно підвищує ступінь руйнування тромбоцитарних агрегатів під дією граміцидину S при всіх досліджених температурах. Однак в умовах експерименту вклад ПОЛ у кумулятивний ефект цього підвищення – сумісно з температурою – знижується з ростом останньої. Як видно з Табл. 5, при 100 С він становить 112%, а при 360 С – лише 12%. В усякому разі підвищення ступеня дезагрегації тромбоцитів може свідчити про полегшення вбудування антибіотика в клітинну мембрану за рахунок того, що окислення ліпідів приводить до порушення її структурної впорядкованості [MarshS.A., 2006] і, як слідство, зниження механічної міцністі.
Доданий до ЗТП б-токоферол, який інгібує процеси ПОЛ (Табл.5), діє протилежним напрямом і суттєво зменшує біологічну активність граміцидину S.
Табл.5.
Вплив індукованого ПОЛ та б-токоферолу на температурну залежність ступеня дезагрегації тромбоцитів (ДТ) при дії граміцидину S
| Показник | Умови експерименту |
Концентрація МДА,нмоль/109 тромбоцитів | Т0 , С | |||
| 10 | 20 | 28 | 36 | |||
| ДТ, % | Контроль | 1,38 ± 0,15 | 15,0 ±1,62 |
21,2** ±2,08 |
35,3** ±2,64 |
39,1 ±3,21 |
| Індукція ПОЛ | 4,15*± 0,78 | 31,9* ±2,75 |
35,0*, ** ±3,04 |
40,1*, ** ±3,35 |
44,0 ±3,80 |
|
| б-токоферол | 0,97*± 0,11 | 23,6* ± 2,21 |
18,1** ± 2,51 |
26,0*, ** ± 2,63 |
23,9* ± 2,94 |
|
Примітка:* - вірогідно відносно контролю (р < 0,05)
** - вірогідно відносно попередньої температури (р < 0,05)
При цьому, починаючи з 20 0 С, .рівень розпаду тромбоцитарних агрегатів навіть нижчій, ніж в контролі.
Розрахунки енергії активації розпаду тромбоцитарних агрегатів при дії граміцидину S показують, що під впливом ПОЛ ії величина суттєво знижується (Табл.6). .Таким чином, окислення ліпідів, що зменшує структурну впорядкованость плазматичної мембрани, водночас знижує і міцність зв’язування тромбоцитів між собою. Цей ефект полегшує антибіотику процес руйнування агрегатів. .
Табл.6.
Вплив індукованого ПОЛ на енергію активації дезагрегації тромбоцитів при дії граміцидину S
| Показник | Умови експерименту | Концентрація МДА,нмоль/109 тромбоцитів | Енергія активації, кДж/моль |
| Дезагрегація тромбоцитів | Контроль | 1,38 ± 0,05 | 415 ± 38 |
| Індукція ПОЛ | 4,15 ± 0,78* | 325 ± 27* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
Дослідження впливу граміцидину S на гемоліз еритроцитів при дії фізичних і хімічних чинників.
В Табл. 7 наведені дані про залежність швидкості і повного часу гемолізуеритроцитів під дією граміцидину S при 200 С. Згідно з отриманими результатами обидва показника гемолізу рівномірно зростають з підвищенням концентрації антибіотика. Найбільш цікавим, однак, у цих результатах є можливість порівняти кількість молекул граміцидину S, які, припадаючи на один еритроцит, викликають гемоліз, з кількістю його молекул на тромбоцит, що приводять як до руйнування індивідуальних клітин, так і їх агрегатів. В одних і тих же умовах ці величини складають (17,46±??)Ч109 і, відповідно (13,01 ± 0,55) Ч106 та (0,86 ± ??) Ч109 молекул антибіотика на клітину.
Табл..7.
Концентраційні залежності швидкості (V) і повного часу (t) гемолізу еритроцитів під дією граміцидину S
| Показник | Концентрація граміцидину S, , мкмоль/л | |||||
| 29 | 31 | 33 | 35 | 37 | 39 | |
| Кількість молекул граміцидину S / еритроцит Ч109 | 17,46 ± 0.873 |
18,67** ± 1,103 |
19,87** ± 1,205 |
21,08* ±1,312 |
22,28* ±1,428 |
23,49* ± 1,508 |
| V, о.о./хвЧ103 | 33 ± 2,9 |
54* ± 5,1 |
67* ± 5,6 |
92* ± 8,5 |
125* ± 11,7 |
150* ± 13,0 |
| t, хв | 15,0 ± 1,8 |
11.67* ± 1,2 |
9,02 ± 0,77 |
8,0* ± 0,063 |
6,67* ± 0,59 |
5,17* ± 0,43 |
Примітка:* - вірогідно відносно мінімальної концентрації граміцидину S (р < 0,05)
Це явище, очевидно, по-перше може бути пов’язано із значно більшими розмірами еритроцитів у порівнянні з тромбоцитами. Але важливішою причиною є, безумовно, різна будова мембран – питомий склад їх білковх та ліпідних компонентів, в обох типів клітин. Саме тому граміцидин S не тільки руйнує мембрану тромбоцитів, як і еритроцитів, але й виступає для перших в якості індуктора агрегації.
В той же час загальні особливості взаємодії граміцидину S з еритроцитами, які базуються на загальних же властивостях мембран будь-яких клітин, мають ті ж характерні риси, що і у випадку тромбоцитів.
З рис.5 видно, що час повного гемолізу еритроцитів знижується, а його швидкість збільшується з підвищенням температури. Декілька слабше, ніж у еритроцитів, але все ж виявляється прискорення гемолізу в облвсті фазових переходів ліпідів мембран.
Як і у випадку тромбоцитів індукція ПОЛ в мембранах еритроцитів збільшує, а його інгібування б – токоферолом – зменшує рівень гемолізу, що іде на протязі одного й того ж часу. під дією граміцидину S.
Сумісна дія підвищення температури і ПОЛ інтенсифікує гемоліз, але вклад цих складових у загальний процес неоднаковий (Рис. 6). ПОЛ змінює, в основному, хімічну структуру ліпідів, в той час, як підвищення температури – їх рухливість. Згідно Рис.6 в області температури тіла рухливість ліпідів відіграє важливішу роль у підвищенні біологічної активності антибіотика.
Вплив ПОЛ на гемоліз еритроцитів, однак, є суттевим. Розрахунки енергії активаціїповного гемолізу, приведені в Табл.8, свідчать, що ПОЛ значно знижує енергетичний бар’єр руйнування мембрани.
Порівняння енергії активації руйнування мембран еритроцитів з енергією активації дезагрегації (Табл.6) показує, що другий процес вимагає більшої енергії. Це може бути пов’язано з меншою доступністю ліпідів, вкритих глікокалісом, в мембрані тромбоцитів, більшим вмістом в ній білків, необхідністю для антибіотика, крім вбудовування в мембрану, розривати щей фібріногенові містки між клітинами.
Табл.8.
Вплив індукованого ПОЛ на енергію активації гемолізy еритроцитів за дією граміцидину S
| Показник | Умови експерименту | Концентрація МДА,нмоль/л | Енергія активації, кДж/моль |
| Гемоліз еритроцитів | Контроль | 5,1 ± 0,53 | 178 ± 23 |
| Індукція ПОЛ | 7,25 ± 0,72* | 109 ± 17* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
Дослідження впливу ліпідного складу мембран еритроцитів на їх гемоліз за дією граміцидину S.
Дослідження залежності гемолізу за дії граміцидину Sеритроцитів здорових донорів і людей з порушеннямі ліпідного обміну, хворих на атероскдлероз і післятромбофлебічний синдром плоказало суттеу залежність стійкості клітинних мембран від їх ліпідного складу (Табл.9). Як видно, швидкість гемолізу еротрицотів вирогідно знижується із збільшенням питомої кількості холестерину і зниженням питомої кількості загальних фосфоліпідів.
Це явище можна пояснити так. На штучних фосфоліпідних мембранах показано [Овчинников Ю.А.,1987], що радікали амінокислотних залишки граміцидин S можуть взаємодіяти с фосфатними групами мембранних фосфоліпідів з утворенням ковалентних зв’язків. Очевидно, зниження відношення холестерин /фосфоліпіди в мембраніх еритроциту зменшує і кількість молекул антибіотика, які спроможні вбудуватися в неї, а тим самим гальмує процес руйнування клітини.
Табл. 9.
Вплив ліпідного складу мембран еритроцитів на швидкість їх гемолізу за дією граміцидину S
| Умови експерименту | Холестерин, % | Фосфоліпіди,% | Холестерин Фосфоліпіди |
Швидкість гемолізу, о.о./хв |
| Контроль | 39,5±0,9 | 47,6±3,2 | 0,83 | 0,35 ± 0,062 |
| Післятромбофлебічний синдром | 44,9±1,4* | 40,5±2,6* | 1,10 | 0,29 ± 0,045 |
| Атеросклероз | 57,7±2,1* | 30,0±2,7* | 1,92 | 0,11± 0,016* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
ВИСНОВКИ
1. У роботі із використанням оптичного методу досліджено концентраційні залежності дії граміцидину S на агрегацію тромбоцитів і гемоліз еритроцитів - як інтактних, так і в умовах модифікації плазматичних мембран г-опроміненням та біологічно активними сполуками в діапазоні температур 40 С - 440 С.
2. Доведено, що взаємодія граміцидину S з інтактними тромбоцитами призводить до їх набрякання і зміни форми, подібної до такої, що відбувається під впливом індукторів агрегації. Цей процесс є Са2+ , Mg2+ - залежним
3. Уперше показано, що граміцидин S руйнує агрегати тромбоцитів, які утворюються під впливом індукторів агрегації, не руйнуючи при цьому плазматичну мембрану клітин.
4. На основі оцінки відношення: кількість молекул граміцидину S/тромбоцит, при яких настає активація тромбоцитів та руйнування їх агрегатів, показано , що її критична величина для першого процесу вища, ніж для другого.
5. Показано, що ступінь і швидкість дезагрегації тромбоцитів граміцидином S найбільші в області структурних фазових переходів ліпідів мембран (180 С – 330 С). При вищих температурах ці параметри дезагрегації знижуються, що свідчить про більшу стійкість агрегатів при температурі тіла.
6. Встановлено, що зменшення впорядкованості ліпідів у плазматичній мембрані тромбоцитів та еритроцитів при їх г-опроміненні чи перекісному окисленні ліпідів веде до полегшення вбудовування граміцидину S у мембрани, але, водночас, призводить й до зменшення міцності зв'язування антибіотика з нею.
7. Уперше показано, що біологічна активність граміцидину S по відношенню до еритроцитів залежить від вмісту холестерину та відношення холестерин/фосфоліпіди в мембранах. Його збільшення знижує гемолітичну дію антибіотика по відношенню до цих клітин.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Ал-Амуш А., Берест В.П., Гаташ С.В., Перский Е.Э. Влияние катионов на агрегацию тромбоцитов // Вісник Харківського національного університету ім. В.Н.Каразіна. Серія: біологія. – 2006. – Вип. 3, № 729. – С. 5-9.
2. Адиб Халаф Фадел Аль Амуш, Берест В.П., Хакл Е.В. Активация и дезагрегация тромбоцитов in vitro при действии грамицидина S // Вісник проблем біології і медицини. – 2007. – Вип. 1. – С. 167-172.
3. Хакл Е.В., Берест В.П., Адиб Халаф Фадел Аль Амуш, Гаташ С.В. Влияние ПОЛ и ионизирующего излучения на дезагрегацию тромбоцитов под действием полипептидного антибиотика грамицидина S // Біофізичний вісник. – 2007. – Вип. 1 (18). – С. 96-101.
4. Адиб Халаф Фадел Аль Амуш, Берест В.П., Хакл Е.В., Перский Е.Э. Влияние температуры на дезагрегацию тромбоцитов, вызванную грамицидином S // Вісник Харківського національного університету ім. В.Н.Каразіна. Серія: біологія. – 2007. – Вип. 5, № 768. – С. 3-9.
5. Аламуш Адіб. Вплив позитивних іонів на агрегацію тромбоцитів / Тези доповідей Першої Міжнародної конференції студентів та аспірантів «Молодь та поступ біології». – Львів, 11-14 квітня 2005. – С. 218.
6. HacklE.V., BerestV.P., АlamushA., GatashS.V., Vasyl’evaL.V. CalciumdependentpathwayofgramicidinSeffectonhumanbloodplatelets / Матеріали ІХ Українського біохімічного з’їзду. – Харків, 24-27 жовтня 2006. – Т. 1. – С. 112.
7. HacklE.V., BerestV.P., Аl-AmoushA., GatashS.V. Interactionofantimicrobialpeptidewithmodelandcellmembranes / Тези доповідей ІV з’їзду Українського біофізичного товариства. – Донецьк, 19-21 грудня 2006. – С. 94-95.
АНОТАЦІЯ
Адіб Халаф Фадел Ал-Амуш. Вплив граміцидину S на агрегацію тромбоцитів і стійкість мембран еритроцитів до гемолізу. Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.13 – фізіологія людини і тварин. Харківський національний університет імені В.Н. Каразіна, Харків, 2008.
Дисертація присвячена вивченню впливу граміцидину S на агрегацію тромбоцитів та стійкість мембран еритроцитів до гемолізу здорових донорів та хворих на деякі серцево-судинні захворювання. Було проаналізовано часові, концентраційні та температурні залежності світлопропускання та оптичної густини збагаченої тромбоцитами плазми (ЗТП) та суспензії еритроцитів для інтактних клітин та після опромінення і активації ПОЛ у клітинах обох типів, а також в залежності від ліпідного складу мембран еритроцитів.
Граміцидин S по-різному впливає на мембрани індивідуальних тромбоцитів та тих, які знаходяться в складі АДФ-індукованих агрегатів.. Він змінює форму та активує їх в першому випадку, при чому цей процес є Ca+
- та Mg+
-залежним. Додання АДФ до ЗТП після граміцидину S призводе
8-09-2015, 23:24
