Результати дослідження та їх обговорення. У більшості хворих на ВХ ДПК, асоційовану з Hp, виявили ознаки больового, диспептичного та астеноневротичного синдромів. Здорові добровольці не мали скарг та не вважали, що мають хронічні, зокрема гастроентерологічні, захворювання. Інфікованість Нpу хворих на ВХ гістологічним методом була підтверджена в антральному відділі у 77 (72,7%), а в тілі шлунка у 70 (63,5%) осіб. Що стосується здорових добровольців, то Нр в антральному відділі виявлявся у 16 (40,0%) випадках, в тілі шлунка у 14 (35,0%) осіб. Аналіз розподілу за ступенями обсіменіння СО не показав вірогідних відмінностей між здоровими добровольцями та хворими. Високий, середній та низький ступені контамінації виявлено у 3 (18,8%), 5 (31,2%) і 8 (50,0%) здорових осіб та у 11 (13,8%), 30 (37,5%) і 39 (48,8%) хворих на ВХ відповідно. Нейтрофільна інфільтрація СО була в усіх обстежених. Мононуклеари (p<0,001) і лімфоїдні фолікули (антрум p<0,001, тіло р=0,027) визначали достовірно частіше у СО хворих на ВХ ДПК, асоційовану з Hp. Атрофію СО тіла шлунка, що супроводжується зниженням її функціональної активності, виявили лише в 18 (16,4%) хворих у тілі та в 10 (9,1%) осіб - в антральному відділі. Метаплазія СО тіла шлунка була у 2 пацієнтів (1,8%), дисплазії не спостерігалось у жодному випадку. Таким чином, виявлений значний відсоток (27,3%) випадків Hp–негативної ВХ, інфікованість Нр здорових осіб і відсутність різниці за ступенями обсіменіння СО між хворими та здоровими свідчать про значну роль неспецифічних факторів захисту в патогенезі ВХ.
Дослідження вмісту основного вторинного продукту ліпопероксидації 4-ГН, який у великих концентраціях є маркером окисного стресу, а в низьких фізіологічних ‑ сигнальною молекулою з різноманітними регуляційними функціями, показало, що він нагромаджується у поверхневому епітелії (р<0,001), власній пластинці (р<0,001) СО шлунка і, що особливо важливо, в ядрах гландулоцитів (р=0,022) хворих на ВХ ДПК, асоційовану з Hp, чого не виявлено у жодного здорового добровольця.
Аналіз прооксидантно/антиоксидантної системи показав, що за деякими показниками аеробного обміну у крові хворих відзначається збільшення рівня первинних продуктів ліпопероксидації ГП, продуктів ОМБ430 та β-ЛП, зниження обох фракцій СМП зі зростанням ІАОА і співмірними із нормальними значеннями активностей каталази й СОД (табл. 1). Ці зміни свідчать про зниження інтенсивності окисно-відновних реакцій і поширення проявів окисного стресу на рівень організму.
Таблиця 1
Динаміка показників, що характеризують аеробний обмін у хворих на виразкову хворобу дванадцятипалої кишки, асоційованою з Helicobacterpylori, M±m
| Показник | ВХ ДПК (група 1), n=21 |
ВХ ДПК (група 2), n=20 |
Здорові добровольці, n=40 |
||
До лікування |
Після лікування |
До лікування |
Після лікування |
||
| Каталаза, мкМ Н2 О2 /мл*год | 0,131±0,002 | 0,115±0,003٭ | 0,129±0,001 | 0,153±0,001٭ | 0,136±0,007 |
| СОД, % інгібування | 11,38±1,44 | 11,81±0,44 | 12,31±0,73 | 9,32±0,24٭# | 12,82±1,11 |
| МДА, мкМ/мл | 71,48±1,47 | 70,87±1,84 | 71,53±0,44 | 78,43±0,50٭# | 71,91±2,23 |
| ІАОА , ум. од. | 1,487±0,024# | 1,481±0,036 | 1,490±0,02# | 1,419±0,011٭ | 1,398±0,027 |
| β-ЛП, ум. од. | 54,30±1,22 | 67,11±0,67٭# | 51,78±0,63 | 52,35±0,28 | 51,49±1,51 |
| ГП, ум. од./мл | 2,44±0,03# | 1,65±0,02٭ | 2,36±0,11# | 1,67±0,01٭# | 1,51±0,08 |
| СМП, 254 нм, ум.од. | 182,6±1,9# | 262,7±4,3٭ | 182,6±1,6# | 229,1±2,9٭ | 241,4±8,7 |
| СМП, 280нм, ум.од. | 230,5±3,9# | 297,1±8,0٭ | 221,8±3,4# | 263,1±1,6٭ | 270,5±12,0 |
| ОМБ, 370 нм, ум.од./мл | 5,18±0,15 | 4,03±0,09٭# | 5,16±0,05 | 6,18±0,12٭# | 4,97±0,19 |
| ОМБ, 430 нм, ум. од./мл | 2,22±0,08# | 1,23±0,06٭# | 2,38±0,07# | 1,99±0,05٭# | 1,63±0,07 |
Примітки:
1. * – різниця достовірна до та після лікування, p<0,05;
2. # –різниця достовірна між здоровими добровольцями та хворими на ВХ ДПК, p<0,05.
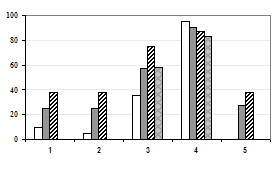
Підтвердженням зниженого адаптаційного резерву у хворих на ВХ ДПК, асоційовану із Hр, є результати вивчення ВСР, підвищення параметрів якої пов’язують із зростанням стресостійкості організму (А.В. Соболев, 2006; О.П. Єлісєєва та ін., 2005; В.В. Попов та ін., 2006). Характерним для хворих на ВХ ДК було зниження ВСР за часовими (SDNN- 34,4 мс проти 50,0 мс у здорових; RMSSD- 16,6 мс проти 38,6 мс у здорових; pNN50 - 1,8% проти 18,5% у здорових) та спектральними (ТР - 1388,6 мс2 проти 3035,1 мс2 у здорових; VLF- 706,2 мс2 проти 850,8 мс2 у здорових; LF- 432,2 мс2 проти 852,0 мс2 у здорових, HF- 242,7 мс2 проти 859,6 мс2 в здорових) параметрами у спокої (фонова проба, лежаче положення). Нами виявлено аналогічне зниження показників ВСР в ортостатичній пробі. Зниження всіх показників у пацієнтів, порівняно із здоровими добровольцями, мало достовірний характер, окрімVLF-коливань у лежачому положенні.
Після проведення індивідуально дозованого ОСІГ, який є оптимальним активуючим чинником, що відображає здатність організму підтримувати SaО2 в умовах гіпоксії, виявлено підвищення більшості показників ВСР. Однак, їх абсолютні значення у хворих були нижчими ніж у здорових добровольців. Такі показники ВСР є виявом функціонально-метаболічної дисфункції та зниженого адаптаційного резерву хворих на ВХ.
Проведення ерадикаційного лікування ефективно усувало клінічні прояви синдрому шлункової та кишкової диспепсії у хворих, котрі приймали у післяерадикаційному періоді лансопразол (група 1) або лансопразол з ІГТ (група 2). Слід зазначити, що троє пацієнтів групи 1, в яких не відбулось ерадикації, продовжували скаржитись на дискомфорт в епігастрії та болючість у цій ділянці під час пальпації. В усіх хворих групи 2 ерадикація була успішною. Крім того, після лікування виявлено вірогідне зменшення скарг на дратівливість та загальну слабкість, порівняно із групою 1.
За результатами ЕГДФС у всіх пацієнтів спостерігалось загоєння виразки СО та зменшувались ознаки дуоденіту. У 35,0 % пацієнтів групи 1 та 18,9 % осіб групи 2 утримувались ознаки гастриту. За результатами гістоморфологічного дослідження у всіх пацієнтів із ВХ ДПК, асоційованою з Нр, досягнуто зменшення інфільтрації СО мононуклеарами і нейтрофільними гранулоцитами, а також кількості лімфоїдних фолікулів. Однак, порівняння результатів лікування між групами показало істотне зменшення кількості осіб із мононуклеарною інфільтрацією СО антрального відділу в групі 2 (позитивними залишилось 14,3% хворих проти 28,6% у групі 1). Ознаки атрофії СО тіла шлунка після лікування виявлено у меншої кількості хворих групи 2 (р<0,05). Таким чином, застосування ІГТ у комплексному лікуванні в післяерадикаційному періоді забезпечило ефективніше усунення проявів запалення СО шлунка у хворих на ВХ ДПК, асоційовану із Hp.
Морфофункціональні зміни після ерадикаційного лікування у пацієнтів групи 1 супроводжувались персистенцією проявів окисного стресу, про що свідчить зростання вмісту 4-ГН у структурах СО шлунка (рис. 1).
 |
 |
![]()
![]() здорові добровольці хворі на ВХ ДПК, асоційовану із H. pylori
здорові добровольці хворі на ВХ ДПК, асоційовану із H. pylori
![]()
![]() хворі групи 1 після лікування хворі групи 2 після лікування
хворі групи 1 після лікування хворі групи 2 після лікування
Рис. 1. Динаміка вмісту 4-гідроксиноненалю у структурах слизової оболонки антрального відділу (а) та тіла (б) шлунка (1 – поверхневий епітелій, 2 – фовеолярний епітелій, 3 – власна пластинка, 4 – цитоплазма гландулоцитів, 5 – ядро гландулоцитів)
Примітки:
1. * – різниця достовірна до та після лікування, p<0,05;
2. # – різниця достовірна між групами після лікування, p<0,05.
Застосування ІГТ у післяерадикаційному періоді (група 2) характеризувалося вірогідним зменшенням вмісту цього маркера окисного стресу і, що особливо важливо, його практично повним усуненням із ядер гландулоцитів власних залоз шлунка. Аналіз перерозподілу 4-ГН за ступенями нагромадження показав збільшення кількості пацієнтів із 0, 1 і 2 ступенем нагромадження 4-ГН у цитоплазмі гландулоцитів пацієнтів групи 2, в той час як у групі 1 переважали хворі із 3-м ступенем нагромадження, особливо у тілі шлунка.
У хворих групи 1 також виявлено зростання кількості осіб із 3-м ступенем накопичення 4-ГН в ядрах гландулоцитів тіла шлунка. Відсутність 4-ГН в ядрах гландулоцитів антрального відділу та істотне його зменшення в ядрах тіла шлунка хворих групи 2 обґрунтовують доцільність застосування ІГТ для корекції проявів окисного стресу у післяерадикаційному періоді.
Ефективність ІГТ підтверджена аналізом показників, що характеризують прооксидантно/антиоксидантну систему у крові (табл. 1). У групі 1 після лікування виявлено істотне зниження активності каталази, нормалізацію показників ГП, ОМБ430 і деяке підвищення рівнів СМП. Підвищений рівень β-ЛП ще більше наростав після лікування у першій групі хворих, що підтверджується збільшенням ризику гіперліпідемії та ожиріння після ерадикації (Т. Kamadaetal., 2005). В цілому, можна стверджувати про загальне зниження інтенсивності аеробного обмінув хворих на ВХ ДПК. Симптоми окисного стресу в такій метаболічній ситуації не проявляються,“маскуються”, що знижує ефективність регенераційних процесів(Л.Т. Малая и др.,1975; М.Ф. Тимочко та ін., 1998; О.П. Єлісєєва та ін.,2003; Т.Г. Сазонтова и др., 2005; Р. Vossetal., 2006)і в подальшому є причиною зниження функціонально-метаболічного резерву та схильності до рецидивів виразки.
Включення ІГТ у лікування після ерадикації сприяє підвищенню антиоксидантної активності. Відзначено нормалізацію рівнівГП, карбонільних похідних основного характеру (ОМБ430 ), двох фракцій СМП. Виявлено достовірне, але в межах нормальних значень, наростання концентрації МДА та рівня карбонільних похідних кислої фракції (ОМБ370 ), що свідчить про ІГТ-індуковану прооксидантну активність. Причому, модуляція активностей основних ферментів АОЗ (достовірне підвищення каталази та зниження СОД) спрямована на підтримання помірної прооксидантної ситуації забезпечується, ймовірно, ефективнішим залученням супероксиду до вільнорадикальних перетворень.
Таким чином, помірний прооксидантний вплив ІГТ забезпечує активацію аеробного обміну у хворих на ВХ ДПК, що супроводжується корекцією дисбалансу в системі прооксиданти/антиоксиданти, може сприяти розпаду/елімінації пошкоджених клітинних структур та ініціювати необхідні саногенні механізми репарації виразкового дефекту СО.
Встановлений різний індивідуальний характер параметрів ВСР у хворих на ВХ зумовив необхідність поділу пацієнтів кожної групи на дві підгрупи, для чіткого виявлення ефективності схем лікування. До підгрупи А входили хворі, загальна спектральна потужність яких у фоновій пробі (лежачи) не перевищувала 1500 мс2 (ТР ≤ 1500 мс2 ). До підгрупи В – пацієнти із ТР > 1500 мс2 . У пацієнтів підгрупи А групи 1 після лікування виявлено ще більше зниження основних параметрів ВСР, зокрема, SDNN(p=0,019) та більшості спектральних параметрів (рис. 2). Незважаючи на таку динаміку, нормалізація симпатовагального індексу та підвищення практично всіх показників ВСР, особливо SDNN, під час ортостатичної проби свідчать про ініціацію покращання функціонального стану у цій підгрупі пацієнтів.

група 1 до лікування група 1 після лікування
![]()
![]()
![]() група 2 до лікування група 2 після лікування
група 2 до лікування група 2 після лікування
Рис. 2. Динаміка змін спектральних показників варіабельності серцевого ритму в хворих на виразкову хворобу дванадцятипалої кишки, асоційовану з Н. рylori, у яких загальна спектральна потужність в лежачому положенні не перевищувала 1500 мс2 (підгрупа А);фонова (а) та ортостатична проби (б)
Примітки:
1. * – різниця достовірна між показниками до та після лікування, р<0,05;
2. # – різниця між групами після лікування достовірна,р<0,05.
Використання ІГТ у післяерадикаційному періоді в пацієнтів із вихідними низькими параметрами ВСР (підгрупа А група 2) супроводжувалось суттєвим підвищенням часових та спектральних показників за рахунок активації нейрогуморальної та автономних компонент регуляції. Аналогічний позитивний вектор змін спостерігався під час ортостатичної проби, що вказує на підвищення адаптаційного потенціалу та більш ефективне усунення проявів функціонально-метаболічної дисфункції у цій групі.
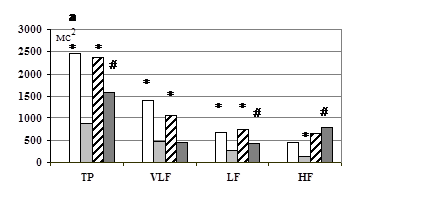
У пацієнтів, що характеризувались вихідними високими параметрами ВСР (підгрупа В), після лікування спостерігалося зниження досліджуваних показників в обох групах (рис. 3), однак, вираженість цих змін суттєво відрізнялась. Високі показники ВСР, які супроводжуються неефективною внутрішньою структурою спектру і ортостатичною реакцією, є прогностично несприятливою ознакою, оскільки вказують на напруженість центральних механізмів регуляції, що в подальшому може призвести до дезадаптаційних зривів. Тому модуляція такої напруженої ВСР (зниження ТР із одночасною нормалізацією внутрішньої структури спектру) може свідчити про оптимізацію роботи регуляційних механізмів і покращання функціонально-метаболічного потенціалу (О.П. Єлісєєва та ін., 2005; А.В. Соболев, 2006), що було виявлено нами у пацієнтів із вихідними високими показниками ВСР (підгрупа В) групи 2. Застосування лише лансопразолу у аналогічній підгрупі групи 1 супроводжувалось надмірним (трикратним) зниженням ТР без покращання внутрішньої структури спектру. Причому, якщо у підгрупі В пацієнтів, які проводили ІГТ, помірне зниження ТР (на 33,5%) супроводжувалось підвищенням амплітуди HF-коливань, то у аналогічній підгрупі групи 1 активність HF-коливань суттєво знижувалась (у 3,2 раза) (рис. 3).

![]()
![]() група 1 до лікування група 1 після лікування
група 1 до лікування група 1 після лікування
![]()
![]() група 2 до лікування група 2 після лікування
група 2 до лікування група 2 після лікування
Рис. 3. Динаміка змін спектральних показників варіабельності серцевого ритму в хворих на виразкову хворобу дванадцятипалої кишки, асоційовану з Н. рylori, загальна спектральна потужність яких в лежачому положенні перевищувала 1500 мс2 (підгрупа В); фонова (а) та ортостатична проби (б)
Примітки:
1. * – різниця достовірна між показниками до та після лікування, (р<0,05);
2. # – різниця між групами після лікування достовірна, (р<0,05).
Оскільки високочастотний пік в спектрі ритмограми (амплітуда HF-коливань) відображає активність парасимпатичного відділу нервової системи, а отже, ефективність відновних процесів, то його зниження після лікування вказує на недостатню компенсацію проявів післяерадикаційного синдрому.
Проведення індивідуально пульсоксиметрично дозованого ОСІГ, контрольованого за параметрами ВСР, вказує на зростання функціонально-метаболічного резерву у хворих групи 2, особливо виражене у пацієнтів із вихідними високими параметрами (підгрупа В). В той же час, пацієнти підгрупи В групи 1 мали найгіршу динаміку ВСРпісля лікування і реакцію-відповідь на ОСІГ.
|
|
|
|

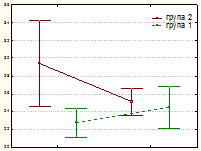 Рис. 4. Динаміка змін часових показників одноразового сеансу інтервальної гіпоксії у хворих на виразкову хворобу дванадцятипалої кишки до та після лікування, M±m
Рис. 4. Динаміка змін часових показників одноразового сеансу інтервальної гіпоксії у хворих на виразкову хворобу дванадцятипалої кишки до та після лікування, M±mТакий ефект є важливим не тільки з огляду на значення ліквідації клітинної гіпоксії (важливого чинника патогенезу ВХ), але й відображає зростання адаптаційного потенціалу макроорганізму, що є необхідною передумовою успішної компенсації проявів післяерадикаційного періоду.
ВИСНОВКИ
У дисертаційній роботі вирішене актуальне наукове завдання підвищення ефективності післяерадикаційного лікування виразкової хвороби дванадцятипалої кишки, асоційованої з H.рylori, шляхом застосування інтервального гіпоксичного тренування як засобу корекції проявів окисного стресу та покращання функціонально-метаболічного резерву організму хворого.
1. Застосування ІГТ забезпечує ефективнішу ліквідацію больового та астеновегетативного синдромів (p<0,05), зменшує прояви гастриту, дуоденіту (p<0,05), а також мононуклеарну інфільтрацію та атрофію СО шлунка (p<0,05).
2. Виявлено зменшення вмісту маркера окисного стресу 4-гідроксиноненалю в поверхневому епітелії, власній пластинці та його повну елімінацію із ядер гландулоцитів (p<0,05) у групі хворих, які застосовували ІГТ, що свідчить про ефективну корекцію проявів окисного стресу на рівні СО шлунка.
3. Встановлено знижену інтенсивність аеробного обміну у крові хворих на ВХ: підвищені рівні ГП, ОМБ430 та ІАОА (p<0,05), нижчий вміст СМП (р<0,001) та співмірні з нормальними значення активності СОД і каталази. Застосування ІГТ сприяє формуванню помірної прооксидантної ситуації: зростання рівнів МДА та ОМБ (р<0,001), нормалізація ГП (р<0,001), СМП (р<0,001), обмеження зростання β-ЛП, підвищення активності каталази (р<0,001) та зниження активності СОД (р<0,001), що є необхідною умовою ефективної корекції проявів окисного стресу.
4. У хворих на ВХ виявлено зниження часових (SDNNна 31,2%, RMSSDна 46,2%, pNN50 на 90,2%) та спектральних (ТР на 54,2%, VLFна 17,0%, LFна 49,3%, HFна 71,8%) параметрів ВСР, що свідчить про низьку активність автономної нервової системи і знижений адаптаційний потенціал організму.
5. Застосування ІГТ у хворих із вихідною низькою ТР ≤ 1500 мс2 попереджує подальше зниження ВСР за рахунок зростання активності парасимпатичних впливів (HFна 82,0% після лікування, р<0,05). У пацієнтів із вихідною високою ТР > 1500 мс2 вплив ІГТ супроводжується зниженням ТР (на 33,5%) з одночасною оптимізацією внутрішньої структури спектру, тенденцією до нормалізації автономного балансу (зниження LF/HFна 10,2%) і зняттям напруження нейрогуморальної регуляції (зниження VLF-коливань на 58,7%), що свідчить про здатність ІГТ модулювати автономний гомеостаз. У хворих із вихідною високою ВСР, які приймали лише лансопразол, різко зменшується ТР (у 2,8 рази) та амплітуда усіх частотних коливань, особливо HF(у 3,2 рази), що відображає втрату мобілізаційної фази адаптаційної реакції і є несприятливим прогнозом для видужання.
6. Проведення індивідуально дозованого ОСІГ, контрольованого за параметрами ВСР, вказує на підвищення стійкості організму до гіпоксії та зростання функціонально-метаболічного резерву у хворих, які у комплексному лікуванні в післяерадикаційному періоді застосовували ІГТ, особливо із вихідною високою ВСР (ТР >1500 мс2 ).
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Після ерадикації комплексне лікування хворих на ВХ ДПК, асоційовану з H.pylori, доцільно доповнювати проведенням ІГТ, що забезпечує корекцію проявів окисного стресу, підвищує показники варіабельності серцевого ритму, модулює вегетативний гомеостаз і сприяє підвищенню функціонально-метаболічного резерву організму.
2. Пропонується проводити ІГТ за допомогою гіпоксикатора ТДИ-01 один раз на добу перед сном, 5-6 днів на тиждень із наступним режимом дихання: три однохвилинні цикли, двохвилинний цикл та трихвилинний цикл з перервами між ними в одну хвилину (1+1+1+2+3), впродовж 1-3 місяців.
3. Для оцінки стану функціонально-метаболічного резерву у хворих на ВХ ДПК, асоційовану з H.pylori, та контролю ефективності лікування доцільно визначати наступні часові (SDNN, pNN50, RMSSD) та спектральні (ТР, VLF, LF, HF) параметри ВСР.
4. Рекомендовано залучати до діагностичного комплексу ВХ ДПК індивідуально пульсоксиметрично дозований одноразовий сеанс інтервальної гіпоксії, контрольований за параметрами ВСР, як метод, що дає інформацію про стійкість організму до гіпоксії, стан
8-09-2015, 22:03
