Дослідження показників рівня естрадіолу у сироватці крові показали, що в нормі рівень естрадіолу становить 42,4±5,92 пг/мл, годування кролів холестерином протягом 180 діб призводить до зниження цього показника майже удвічи 21,86±6,48 пг/мл (табл.2). Після відміни холестеринової дієти вже на 1-му тижні регресу рівень естрадіолу знизився до 9,65±0,75 пг/мл. Поступове невірогідне зменшення рівня естрадіолу продовжувалось до кінця 3-го тижня.
Таблиця 1.
Динаміка показників ліпідного обміну в сироватці крові
експериментальних тварин у нормі, на піку розвитку моделі, при
регресі атеросклерозу та введенні АКП (ммоль/л)
| Группитварин | ЗХС | ЛПВЩ | ТГ | ЛПДНЩ | ЛПНЩ | КА | |
| Інтактні тварини | 2,87±0, 19 | 0,33±0,03 | 1,70±0,16 | 0,78±0,07 | 1,82±0,18 | 8,07±0,81 | |
| Пік моделі | 12,76±1,22*# | 0,25±0,02# | 1,45±0,10 | 0,66±0,05 | 11,86±1,21*# | 47,64±4,16*# | |
| 1 тижд. | регрес | 3,79±0,35* | 0,35±0,03* | 1,84±0,18 | 0,84±0,07 | 2,67±0,25*# | 10,23±1,12* |
| 2 тижд. | регрес | 2,07±0, 20* | 0,16±0,01*# | 2,88±0, 19*# | 1,32±0,09*# | 0,76±0,07*# | 11,94±1,02# |
| 3 тижд. | регрес | 2,63±0,24* | 0,32±0,02* | 1,49±0,11* | 0,68±0,05* | 1,62±0,26* | 7,29±0,96* |
| 1 тижд. | АКП | 2,48±0,23* | 0,36±0,03 | 3,55±0,34*# | 1,63±0,16*# | 0,42±0,04*# | 6,15±0,60*# |
| 2 тижд. | АКП | 2,42±0,14# | 0,28±0,02* | 1,73±0,16* | 0,79±0,07* | 1,35±0,12* | 8,16±0,89 |
| 3 тижд. | АКП | 1,45±0,04* # | 0,36±0,01* | 0,72±0,11*# | 0,33±0,05*# | 0,76±0,04* # | 3,83±0,41* # |
Примітка: * - розходження показників ліпідного обміну вірогідні відповідно до попередніх в ході експерименту, р< 0,05; # - розходження показників ліпідного обміну вірогідні відповідно до групи контролю, р< 0,05.
У групі тварин після введення АКП також спостерігалось зниження рівня естрадіолу відносно показників на піку моделі (13,93±3,74 пг/мл), але рівень естрадіолу був вірогідно вищий, ніж у підгрупі з регресом атеросклерозу, в аналогічні терміни спостереження.
Надалі спостерігалося поступове невірогідне зменшення рівня естрадіолу, яке продовжувалось до кінця 3-го тижня. При порівняльному аналізі показників рівня естрадіолу у наведених підгрупах встановлено, що його рівень протягом 3-х тижнів був вірогідно вище у 2-й підгрупі тварин.
Таблиця 2.
Динаміка показників рівня естрадіолу в сироватці крові
експериментальних тварин, пг/мл
| Групи тварин | Тижні експерименту | ||
| 1 тиждень | 2 тиждень | 3 тиждень | |
| Контроль | 42,4±5,92 | ||
| Пік моделі | 21,86±6,48 | ||
| Спонтанний регрес | 9,65±0,75 | 8,85±1,47 | 8,63±0,24 |
| Введення АКП | 13,93±3,74* | 14,8±2,36* | 14,65±2,2* |
Примітка: * - розходження показників вірогідні відповідно до підгрупи зі спонтанним регресом, р< 0,05.
Кореляційний аналіз між показниками ліпідного обміну та рівнєм естрадіолу в сироватці крові виявив прямий вірогідний зв’язок між показниками ЗХС та ЛПНЩ у двох досліджуваних підгрупах (табл.3).
Таблиця 3.
Коефіцієнт кореляції між показниками ліпідного обміну та
показниками рівня естрадіолу в сироватці крові експериментальних
тварин
| Підгрупи тварин | Показники ліпідного обміну | |
| ЗХС | ЛПНЩ | |
| Регрес моделі | r = 0,996 p = 0,003 |
r = 0,995 p = 0,007 |
| Введення АКП | r = 0,99 p = 0,01 |
r = 0,998 p = 0,001 |
Таким чином, порівняльний аналіз стану ліпідного обміну при спонтанному регресі атеросклерозу і при такому з введенням АКП, встановив істотні вірогідні розходження у темпі та якості змін ліпідного спектра.
Отримані дані свідчать про те, що введення АКП на тлі регресу стимулює нормалізацію показників ліпідного обміну у експериментальних тварин, і, можливо, сприяє регресу атеросклеротичного процесу.
Таким чином, введення АКП на тлі регресу впливає на рівень естрадіолу в сироватці крові експериментальних тварин, за рахунок дії естрадіолу та можливо, посилює захват ЛПНЩ гепатоцитами через рецептор-обумовлений механізм.
Частота й поширеність осередків ліпоїдозу в інтимі аорти кролів в експерименті.
При дослідженні аорт інтактних твариносередки ліпоїдозу не спостерігались.
Аналіз поширеності осередків ліпоїдозу на піку розвитку атеросклерозу показав, що середній відсоток площі поразки грудного відділу аорти склав 46,51±13,85%. Морфометрично поширеність осередків ліпоїдозу у тварин з регресом (6 тижнів) становила 7,06±4,38%, що було вірогідно нижче, ніж у тварин на піку моделі (р<0,05). Після введення АКП поширеність осередків становила 0,89±0,37%, що було вірогідно нижче, ніж у тварин на піку моделі й при спонтанному регресі (р<0,05).
У тварин після введення АКП у ділянках типового розташування ліпідних утворень виявлялися чашеподібні вдавлювання. Ділянки суданофілії виявлялися навколо чашеподібних вдавлювань. Мікроскопічний аналіз чашеподібних вдавлень показав, що їх локалізація відповідала розташуванню атеросклеротичних бляшок. Стінка аорти в цих ділянках стоншена, на краях - потовщена й трохи піднята над люмінальною поверхнею у вигляді суданофільного валика.
Результати візуально-планіметричного дослідження показали, що частота й поширеність осередків ліпоїдозу залишалися вірогідно вищими в групі тварин зі спонтанним регресом атеросклерозу, ніж у підгрупі введення АКП.
Характеристика осередків ліпоїдозу аорти при моделюванні експериментального атеросклерозу, при його спонтанному регресі й на тлі введення АКП. При моделюванні атеросклерозу на люмінальній поверхні аорти виявлено 2 види осередків ліпоїдозу: ліпідні смужки та бляшки.
При регресі атеросклерозу неоінтимальні ділянки зустрічалися винятково в місцях гемодинамічної травматизації. Середня третина медії аорти петрифікована, осередки кальцинозубули або кільцеподібної форми, охоплюючи периметр судини, або уформінапівмісяця. У ділянках медії аорти з петрифікатами відзначали масивну круглоклітинну інфільтрацію з боку інтими таадвентиції.
У місцях чашеподібнихвдавлювань, виявлених у стінці аорти на тлі введення АКП, гістологічно визначалося стоншення медії аорти в центрі та валикоподібні стовщення стінки по краях. Верхівки валикоподібних стовщень, розташованих проти току крові, були утворені скупченнями пінистих клітин і макрофагів, які були розташовані перпендикулярно внутрішнійеластичній мембрані. При детальному аналізі судинної мережі, розташованої в субендотеліальному просторі, доведено, що вона являє собою систему vasavasorum, утворену моношаром ендотелію, та безпосередньо примикає до гладком’язових клітин.
Таким чином, у середній третині медії аорти, де на піку холестеринової моделі виявлялися ділянки дистрофії та некрозу, розташовувалися ділянки кальцинозу. Реакція судинної стінки на петрифікацію полягає в гіперплазії модифікованих гладком’язових клітин середньої оболонки, які лізують петріфикат і транспортують продукти лізису за системою vasa vasorum у венозні й лімфатичні колектори адвентиції аорти. Введення АКП перешкоджає петрифікації стінки аорти. Наші дослідження доводять, що цей ефект досягається прискореним зворотним розвитком атеросклеротичних уражень за рахунок участі клітинних елементів крові тастимуляції неоангіогенезу. Після введення АКП у середній оболонці аорти бурхливо розвивається мережа vasa vasorum, яка досягає внутрішньої еластичної мембрани й поширюється в субендотеліальний простір. Такий потужний судинний дренаж, досягаючи основи бляшки, призводить до швидкої резорбції атероматозного ядра та утворення описаних чашеподібнихвдавлювань. На наш погляд, прискорений регрес атеросклерозу аорти у кролів можна пояснити тим, що введення АКП стимулює ангіогенез і сприяє прискореному регресу за рахунок посилення трофіки в місцях атеросклеротичних уражень.
Експериментальна гіперхолестеринемія й лейкоцитарний кліренс ліпідів при введенні АКП. Згідно з даними деяких авторів, зворотний транспорт надлишку холестерину з інтими артерій може здійснюватися шляхом ретроендоцитозу ендотеліальними клітинами, а також за рахунок лейкоцитарного кліренсу ліпідів з осередків атеросклеротичних уражень (GerrityR. G., 1981; Климов А.Н. 1986). У тварин контрольної групи кількість «ліпіднавантажених» лейкоцитів крові не перевищувала 12%.
Результати порівняльного аналізу динаміки процентноїкількості«ліпіднавантажених» лейкоцитів в ході експерименту подані на рис.1.
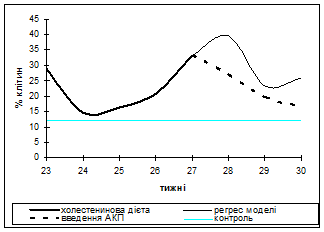 |
При моделюванні атеросклерозу процентне число ліпіднавантажених лейкоцитів до 23 тижня становило 28% від загального числа лейкоцитів, до 24 тижня їх кількість знижувалась до 14%, потім поступово зростало й на піку моделі становила близько 35%. Протягом наступного тижня відзначалося зростання їхнього числа до 40%.
Рис.1. Лейкоцитограма крові кролів на піку розвитку експериментального атеро-склерозу, його регресу та після введення АКП
Що стосується введення АКП на тлі регресу, то процентна кількість«ліпіднавантажених» лейкоцитів після введення знижувалося на першому тижні до 24%, на 2-му тижні становила 16% і на 3-му - 9%. По цитологічним і морфометричним показникам ці клітинні елементи відповідали моноцитам і сегментоядерним лейкоцитам.
З огляду на різну динаміку зміни процентного числа «ліпіднавантажених» лейкоцитів у крові в ході експерименту, нами проаналізований ступінь можливих взаємозв'язків між числом «ліпіднавантажених» клітин і показниками ліпідного обміну при спонтанному регресі й такому при введенні АКП (табл.4).
При цьому (див. табл.4) найбільш вірогідні та значні взаємозв'язки існували: з ТГ, ЛПДНЩ, ЛПВЩ.
Наявність ліпідних включень у цитоплазмі лейкоцитів свідчить про існування механізму кліренсу ліпідів із крові. При введенні кріоконсервованої плаценти високий кореляційний взаємозв'язок між кількістю «ліпіднавантажених» лейкоцитів і ТГ, ЛПВЩ, ЛПДНЩ свідчить про участь лейкоцитів у прискореній утилізації атерогенних фракцій холестерину із крові.
Порівняльна морфологічна оцінка ангіотрофичних ефектів кріоконсервованої плаценти. Дані морфологічного дослідження показали, що у кролів 3-ї підгрупи 2-ї групи відзначалося стовщення інтими в магістральних судинах коронарних артерій, що приводило до редукції кровотоку, дистрофії кардіоміоцитів і розвитку осередкового кардіосклерозу.
Таблиця 4
| Коефіцієнт кореляції між показниками ліпідного обміну й процентною кількістю «ліпіднавантажених» лейкоцитів у крові | |||||
| Показники ліпідного обміну | |||||
| Групи тварин | ЗХС | ЛПНЩ | ЛПДНЩ | ТГ | ЛПВЩ |
| Регрес моделі | r = 0,48 p = 0,58 |
r = 0,41 p = 0,59 |
r = 0,11 p = 0,6 |
r = 0,1 p = 0,89 |
r = 0,63 p = 0,37 |
| Введення АКП | r = 0,01 p = 0,98 |
r = 0,08 p = 0,91 |
r = 0,98 p = 0,01 |
r = 0,98 p = 0,01 |
r = 0,98 p = 0,02 |
У кролів 1 підгрупи через 6 тижнів не спостерігалося регресу атеросклеротичних змін в артеріях і збільшення щільності розподілу інтрамуральних судин. Введення АКП приводило до регресу атеросклеротичних уражень у магістральних судинах коронарних артерій і до прискореного ангіогенезу інтрамуральних судин міокарда, що підтверджується вірогідним збільшенням їх щільності на одиницю площі серцевого м'яза (табл.5).
Отже, отримані дані вказують на те, що введення АКП сприяє прискореному зворотному розвитку експериментального атеросклерозу й неоваскуляризації міокарда.
Таблиця 5.
Щільність розподілу інтрамуральних судин у міокарді в ході
експерименту (1/мм2).
| Контроль | Пік моделі | Регрес | Введення АКП |
| 4,5±0,5 | 2,5±1,5* | 2,36±0,36* | 5,0±1,0** |
Примітка: * - вірогідно в порівнянні з контролем (р<0,05);
** - вірогідно в порівнянні з групою регресу
Світлооптична й ультраструктурна характеристика ендотелію в нормі, при моделюванні атеросклерозу, його спонтанному регресі й після введення АКП. Як відомо, однією з основних причин виникнення й розвитку атеросклерозу є порушення проникності ендотелію.
Порушення ендотеліального транспорту може проявлятися в посиленні трансендотеліального транспорту ЛПНЩ у субендотеліальний простір у складі облямованих і необлямованих везикул (VanHinsberghV. W., 1983,RyanU. S., 1986), а також через дефекти в міжендотеліальних контактах (ZandT., 1981). Порівняльний аналіз препаратів ендотелію аорти контрольних тварин показав, що моношар складається з витягнутих уздовж аорти клітин з вузькими міжендотеліальними межам, по ходу яких зустрічаються дрібні "ґудзикові" утворення й великі кільцеподібні структури, - "стигмати" і "кратери". За метричними параметрами площа стигмати не перевищує 6 мкм2 і відповідає наскрізному дефекту міжендотеліальних контактів. Електронно-мікроскопічний аналіз підтвердив, що стигмата являє собою мінімальну розбіжність цих контактів. По ходу міжендотеліальних кордонів зустрічаються кратери – великі (10 - 16 мкм2), округлої форми аргірофільні утворення, які іноді набувають вигляду кільцеподібних структур, а при дослідженні в РЕМ встановлено, що це кратероподібні об'єкти кільцеподібної форми з тонкими аргірофільними кордонами.
Як показали результати морфологічного дослідження ендотелію аорти з регресом атеросклерозу (6 тижнів), моношарендотеліальних клітин не порушений. Ендотеліоцити представлені вузькими клітинами з тонкими міжендотеліальними кордонами, які орієнтовані уздовж вісі судини. По ходу міжендотеліальних кордонів зустрічаються переважно стигмати, а кратери розташовуються окремими групами в кількості 2-4 в полі зору.
Аналіз стану проникності ендотелію в той же строк, який був проведений на підставі підрахунку кількості міжклітинних дефектів, виявив 2,5-кратне вірогідне зниження кількості стигмат і майже 5-кратне зниження кількості кратерів у порівнянні з піком експериментальної моделі атеросклерозу (Табл.6).
Разом з тим, введення АКП не приводило до ще більшого вірогідного зменшення кількостікратерів.
Генез наскрізних міжклітинних дефектів ендотелію у виді стигмат і кратерів залишається мало вивченим. Існує думка, що утворення мінімальних міжендотеліальних дефектів у виді стигмат може бути пов'язане з токсичною дією надлишку холестерину в крові (Климов А.Н., 1999).
Таблиця 6.
Особливості частоти міжклітинних дефектів у моношарі ендотелію
аорти кролика на піку, при регресі атеросклерозу і після введення АКП
| Модель атеросклерозу | Регрес атеросклерозу | Введення АКП | |||
| Стигмати | Кратери | Стигмати | Кратери | Стигмати | Кратери |
| 63,0±5,79 | 19,5±1,03 | 25,50±1,50* | 4,50±0,29* | 12,50±3,28* ** | 5,75±0,63* |
Примітка. Розрахунок міжклітинних дефектів ендотелію робили на 100 клітин.
* - вірогідно в порівнянні з моделлю атеросклерозу (р<0,01);
** - вірогідно в порівнянні зі спонтанним регресом моделі атеросклерозу (р<0,05).
Максимальну розбіжність міжендотеліальних контактів у вигляді кратерів більшість авторів пояснює як наслідок зворотного транспорту макрофагів і лейкоцитів із субендотеліального простору у кровоток (Нагорнев В.А., 1981).
Популяційний склад ендотелію аорти у нормі, на тлі регресу атеросклерозу і після введення АКП. Порівняльний аналіз морфологічних змін ендотелію аорти кролика в нормі й при експериментальному атеросклерозі показує, що найбільш інформативними морфологічними маркерами морфофункціонального стану ендотелію можутьбути кількість стигмат, кратерів і площа ендотеліальних клітин. Перші два параметри (стигмати й кратери) вказують на ступінь проникності ендотелію в моношарі. Площа ендотеліоцитів, можливо, є інтегральним показником змін функціональної та проліферативної активності клітин, яка відбувається під впливом атерогенних стимулів.
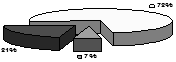
Дані морфометричного дослідження показали, що ендотелій у моношарі аорти є гетерогенним як у нормі, так і на піку розвитку атеросклерозу. За даними літератури гетерогенність ендотеліальних клітин у моношарі обумовлена певною проліферативною потенцією клітин, яка забезпечує гомеостаз двовимірної тканини. Ендотеліальні клітини з великою площею утворюють проліферативній пул готових до розділу ендотеліоцитів. Малі ендотеліальні клітини є клітинами-нащадками великих ендотеліоцитів, які поділились(Маресин В.М., 1982) (рис.2 а).
Як видно із представленої діаграми, ендотелій складається з дуже малих ендотеліоцитів, середніх і гігантських ендотеліальных клітин. Однак, площа ендотеліоцитів на піку експериментального атеросклерозу вірогідно більше (р<0,05), чим у контрольних тварин (рис.2 б).
Збільшення площі ендотеліоцитів у тварин з експериментальним атеросклерозом може бути обумовлена посиленням проліферативної активності ендотеліальних клітин у відповідь на аліментарну гиперхолістеринемію, при якій площа клітин, що діляться, значно зростає.
 |
 |
 |
абв
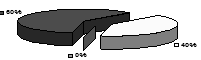
Рис.2. Розподіл ендотеліоцитів у моношарі аорти кролика залежно від їхнього логарифма площі розраховане на 100 клітин: а - контрольної групи, б - при регресі атеросклерозу, в - після введення АКП.
Як видно з рис.2 в, введення АКП на тлі регресу атеросклерозу приводило до збільшення кількості ендотеліоцитів з малою площею поверхні, що характерно для тварин контрольної групи. Це пояснюється відновленням проліферативної активності ендотеліоцитів у відповідь на введення АКП.
Проведений порівняльний аналіз морфології ендотеліальних клітин аорти, морфометричних особливостей площі ендотеліоцитів, а також ступеня його проникності, яка розрахована кількістю міжендотеліальних дефектів, показує, що при введенні АКП досліджувані показники наближаються до показників групи контрольних тварин. Отримані дані вказують на виражені ангіопротекторніта ангіотрофічні ефекти АКП.
ВИСНОВКИ
Актуальною проблемою сучасної медицини є терапія атеросклерозу. В Україні показники захворюваності, інвалідності і смертності внаслідок атеросклерозу та його ускладнень досить високі, вони посідають перше місце та в 2-4 рази вищі, ніж у країнах ЄС і світу (більше 68% від показника загальної смертності). У дисертаційній роботі виявлені антиатерогенні ефекти дії алогенної кріоконсервованої плаценти; досліджені та експериментально обґрунтовані можливі механізми дії алогенної кріоконсервованої плаценти на основні ланки атерогенезу в кролів з моделлю експериментальною атеросклерозу.
Введення фрагментів алогенної кріоконсервованої плаценти приводило до швидкої (протягом одного тижня) нормалізації ліпідного спектра сироватки крові кролів ЗХС від 12,76±1,22 до 2,48±0,23 ммоль/л, і ЛПНЩ від до 0,42±0,04 ммоль/л в той час, як при процесі регресу експериментального атеросклерозу ці показники були ЗХС - 3,79±0,35 ммоль/л та 2,67±0,25 ммоль/л відповідно. Це вказує на те, що АКП має значну гіполіпідемічну дію.
Введення фрагментів алогенної кріоконсервованої плаценти приводило до швидкого (протягом одного тижня) та стабільного (протягом 3 – х тижнів) збільшення рівня естрадіолу сироватки крові кролів 13,93±3,74 пг/л у порівнянні з показниками при регресі атеросклерозу які становили - 9,65±0,75 пг/л. Високий коефіцієнт кореляції між рівнем естрадіолу та такими показниками ліпідного обміну як ЗХС і ЛПНЩ (r=0,99; р=0,01) у тварин з введенням АКП вказує на посиленну елімінацію ЛПНЩ гепатоцитами через рецептор-обумовлений механізм.
Використання фрагментів алогенної кріоконсервованої плаценти приводило до зменшення площі осередків ліпоїдозу аорти (строк спостереження 6 тижнів) з 46,51±13,85% до 0,89±0,37%, що було вірогідно нижче, ніж у тварин з регресом (7,06±4,38%; р<0,05).
Введення фрагментів АКП супроводжувалось відновленням структурно-функціональної цілісності ендотелію. Проявом відновлення було зменшення кількості міжендотеліальних дефектів (стигмат і кратерів) з 63,0±5,79 і 19,5±1,03 до 12,50±3,28 і 5,75±0,63, в той час, як при регресі атеросклерозу ці показники були 25,50±1,50 і 4,50±0,29 відповідно. Введення АКП призводило до нормалізації популяційного складу ендотелію (появлення ендотеліоцитів з малою площею) на відміну від підгрупи з регресом атеросклерозу. Отримані дані вказують на виражені ангіопротекторніта ангіотрофічні ефекти АКП.
Проведені дослідження свідчать, що введення фрагментів алогенної кріоконсервованої плаценти стимулювало систему мононуклеарних фагоцитів, ознакою чого було вірогідне зменшення кількості «ліпіднавантажених» лейкоцитів з 35% до 9% протягом 3 тижнів, при регресі атеросклерозу у ті ж терміни цей показник був 26%.
Використання фрагментів алогенної кріоконсервованої плаценти через 6 тижнів приводило до збільшення кількості інтрамуральних судин у міокарді з 2,5±1,5 до 5,0±1,0 на мм2, на відміну від тварин з регресом атеросклерозу, у яких ці показники змінювались з 2,5±1,5 до 2,36±0,36. Це вказує на ангіотрофічні ефекти АКП.
ПЕРЕЛІК РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Кондаков И.И. Антиатерогенные эффекты криоконсервированного препарата фетоплацентарного комплекса при экспериментальном атеросклерозе // Проблеми криобиологии. - 2005. - Т.15, №3. - С.435 - 439.
2. Кондаков И.И. Проницаемость эндотелия и предикторы нарушения эндотелиальной функции // Кровообіг та гемостаз. - 2005. -№3-4. -С.94-97.
3. Кондаков И.И., Юрченко Т.Н., Жуликова Е.П. Экспериментальная гиперхолестеринемия и липидкорригирующие эффекты при введении криоконсервированной плаценты // Світ медицини та біології. – 2007 - № 1 – С.46-50.
4. Кондаков И.И. Антиатерогенные эффекты фетоплацентарного комплекса в обратном развитии экспериментального атеросклероза // Запорожский медицинский журнал. - 2005. - №3. - С.122-123.
5. Кондаков И.И. Использование показателей лейкоцитарного клиренса липидов для контроля над адекватностью холестериновой модели атеросклероза у кроликов
8-09-2015, 19:53
