3. Дослідження на моделі гіповітамінозно- метіонінової ГГЦ
На цій моделі вивчена лікувальна дія ВМК та препаратів порівняння. Суть цієї моделі ГГЦ полягає в згодовуванні тваринам протягом 14 діб основної дієти (ОД), збагаченої L-метіоніном (1% до сухої маси), але позбавленої вітамінів В6 , В9 та В12 . Визначення вітамінного статусу показало, що вітамінна недостатність проявилась у зниженні в печінці активності піридоксальфосфатзалежних ферментів АЛТ з 76,3±4,6 в контролі до 59,3±2,7; АСТ – з 37,3±1,6 в контролі до 25,3±1,2 ммоль/год/мг білку (Р<0,05), зниженні в плазмі крові фолату на 2,4 нг/мл та підвищеній (у 2,4 рази) екскреції з сечею метилмалонової кислоти. Лікування ГГЦ та індукованих нею порушень здійснювали шляхом введення тваринам ВМК або препаратів порівняння протягом 4; 10 та 20 діб. Крім того, на цій моделі досліджена дозозалежна гіпогомоцистеїнемічна дія ВМК, для чого тваринам з ГМГ вводили дозу ВМК, яка в 2 рази перевищує добову (2ВМК), або є в два рази меншою за добову (1/2ВМК).
3.1. Гематологічні та біохімічні дослідження
Гематологічні дослідження. У тварин з ГМГ в крові виявлено достовірне зниження рівня гемоглобіну (до 107,0±3,1 проти 133,0±4,8 г/л в інтактному контролі) та кількості лейкоцитів (до 10,00±0,71 проти 12,80±0,39 тис/мм3 в інтактному контролі), що було наслідком недостатності в дієті вітамінів В6 , В9 та В12 . Після лікування тварин з ГМГ протягом 4 діб за допомогою ВМК рівень гемоглобіну вже не відрізнявся від контролю (120,0±3,7; Р>0,05), в той час як кількість лейкоцитів утримувалась на зниженому рівні (10,50±0,68; Р<0,05). Лікування тварин з ГМГ введенням ПП-1, ПП-2, а також харчуванням повноцінною ОД протягом 4 діб не призвело до нормалізації цих показників. Після лікування тварин протягом 10 та 20 діб ВМК, ПП-1, ПП-2 та повноцінною ОД всі гематологічні показники виявилися нормальними. Таким чином, здатність ВМК нормалізувати гематологічні зрушення, індуковані вітамінною недостатністю, виявилася вищою у порівнянні з референс-препаратами та ОД.
Рівень ГЦ. Через 4 доби лікування ВМК концентрація ГЦ знизилася до рівня, нижчого від контролю і залишалась такою до 10 доби досліду. Під впливом препарату ПП-1 концентрація ГЦ нормалізувалася на 4 добу лікування і залишалася на такому рівні до кінця досліду. Разом з тим рівень ГЦ через 4 та 10 діб лікування препаратами ПП-1 та ПП-2 виявився вищим, ніж у тварин, яких лікували ВМК. Гіпогомоцистеїнемічна дія препарату ПП-2 була не тільки нижчою у порівнянні з ВМК, але через 4 доби лікування не досягла рівня інтактного контролю. На 20 добу досліду рівні ГЦ були однаковими при застосуванні всіх трьох комплексів – ВМК, ПП-1 та ПП-2 (див. рис.1). Таким чином, на моделі ГМГ ступінь гіпогомоцистеїнемічної дії ВМК виявився більшим, ніж у препаратів порівняння ПП-1 та ПП-2.
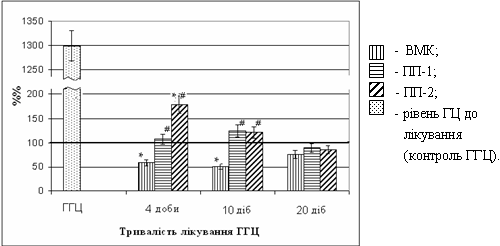
Рис. 1. Гіпогомоцистеїнемічна дія комплексу ВМК та препаратів порівняння (ПП-1 та ПП-2) в процесі лікування тварин з ГМГ.
* - Р≤0,05 у порівнянні з інтактним контролем;
# - Р≤0,05 у порівнянні з групами, що лікувалися ВМК.
Вивчена також дозозалежна гіпогомоцистеїнемічна дія ВМК. Показано, що збільшення добової дози ВМК в два рази не підсилює гіпогомоцистеїнемічну здатність цього комплексу, в той час як зменшення дози в два рази достовірно знижує його специфічну активність.
Процеси оксидативного стресу та ендогенної інтоксикації. Виявлено (табл. 3), що концентрація білків в сироватці крові у всіх тварин була в межах норми, в той час як рівні кетогруп білків, малонового діальдегіду та середніх молекул за ГМГ (група 3) виявились підвищеними (Р<0,05). Гіповітаміноз сам по собі не змінив на достовірну величину ці показники (група 2).
Лікування тварин з ГМГ протягом 4-х діб ВМК (група 4), як і препаратами порівняння (групи 5 та 6), призвело до нормалізації рівня кетогруп білків, чого не спостерігалось при харчуванні тварин тільки повноцінною (основною) дієтою (група 7). Таким чином, здатність ВМК знижувати пероксидацію білків, індуковану ГМГ, виявилась однаковою з препаратами порівняння ПП-1 та ПП-2.
Лікування тварин ВМК, як і препаратом ПП-2 (групи 4 та 6), призвело до зниження рівня малонового діальдегіду у порівнянні з контролем ГМГ (група 3; Р<0,05), а лікування тварин препаратом ПП-1 виявилось менш ефективним. Разом з тим, всі застосовані протягом 4 діб методи лікування тварин (за допомогою ВМК, ПП-1, ПП-2 та ОД) не призвели до нормалізації рівня МДА в сироватці крові (див.табл.3).
Таблиця 3
Вплив 4-х добового введення в організм ВМК, ПП-1, ПП-2, а також харчування основною дієтою (ОД) на динаміку біохімічних показників крові тварин за гіповітамінозно-метіонінової гіпергомоцистеїнемії (М±m)
| № груп | Умови досліду | Сироватка крові | Середні молекули, екстинція | ||
| білок, г/л | кетогрупи білків, мкг/100 мг | малоновий діальдегід, мкмоль/л | |||
| 1 | Інтактні тварини | 67,80±3,05 | 45,80±3,20 | 44,7±2,4 | 0,276±0,020 |
| 2 | Гіповітаміноз (контроль) | 62,00±2,81 | 57,30±4,30 | 52,3±3,3 | 0,228±0,028 |
| 3 | ГМГ без лікування (контроль ГГЦ) | 66,00±2,30 | 72,20±4,07* | 73,7±4.6* | 0,424±0,016* |
| Лікування ГМГ протягом 4 діб | |||||
| 4 | ГМГ + ВМК | 64,60±3,05 | 53,70±3,55# | 57,1±3,3*# | 0,212±0,021*# |
| 5 | ГМГ + ПП-1 | 68,60±3,12 | 55,20±3,84# | 64,8±3,5* | 0,249±0,021# |
| 6 | ГМГ + ПП-2 | 66,60±3,00 | 54,40±3,78# | 56,5±4,0*# | 0,256±0,022# |
| 7 | ГМГ + ОД | 65,60±4,20 | 68,50±3,70* | 70,4±3,9* | 0,355±0,020* |
Примітки:
1. * - Р≤0,05 у порівнянні з інтактним контролем;
2. # - Р≤0,05 у порівнянні з контролем ГГЦ.
Наші дослідження показали, що лише лікування протягом 10 діб за допомогою ВМК і препаратів порівняння (але не ОД) здатне нормалізувати рівень МДА в сироватці крові тварин з ГМГ. Така ж ситуація спостерігалась відносно стану ендотоксикозу, який знизився під впливом ВМК та препаратів порівняння (але не ОД) практично до одного рівня. При дослідженні гомогенатів печінки виявлено залежне від ГМГ підвищення концентрації КГ білків, МДА та ГП при нормальній концентрації білка та активності супероксиддисмутази (СОД). Під впливом лікування протягом 4 діб ВМК показав рівну з ПП-1 та ПП-2 активність щодо нормалізації рівня ГП та майже однакову з ПП-2 здатність до зниження концентрацій МДА та КГ білків, причому антиоксидантна дія препарату ПП-1 виявилась нижчою у порівнянні з ВМК та ПП-2. Всі досліджені в печінці показники оксидативного стресу вже не відрізнялися від інтактного контрою через 10 діб лікування ВМК та препаратами порівняння.
Дещо інша картина виявлена при дослідженні гомогенатів нирки. Як і у випадку з гомогенатом печінки, ГМГ викликала в нирках активацію процесів оксидативного стресу при відсутності впливу на концентрацію загального білка та активність СОД. Вже після 4 діб лікування тварин з ГМГ за допомогою ВМК, ПП-1 та ПП-2 концентрації ГП та МДА не відрізнялися від інтактного контролю. Всі три препарати знизили утворення КГ білків, хоча їх рівень залишався статистично вищим, у порівнянні з інтактним контролем. Проте проведені дослідження показали, що збільшення до 10 діб терміну лікування тварин з ГМГ введенням ПП-1 не призвело до нормалізації рівня КГ, це сталося лише після 20-ти добового лікування. Натомість, під впливом ВМК, як і ПП-2, застосованих упродовж 10 діб, рівень КГ досяг показників інтактного контролю.
Дані, отримані на гомогенатах печінки та нирок, свідчать про те, що в умовах ГМГ досліджуваний ВМК має рівну з ПП-2 та вищу від ПП-1 здатність протидіяти прооксидантним властивостям ГЦ.
3.2. Морфологічні дослідження (патанатомічні, гістологічні, гістохімічні)
При зовнішньому огляді, патологоанатомічному розтині, визначенні абсолютної та відносної маси органів щурів з ГМГ ніяких змін відносно контролю не було виявлено.
Проведено гістологічне та гістохімічне дослідження органів тварин – серця, легенів, печінки, нирок, шлунку та кишківнику, сім’яників, передміхурової залози, сітківки ока та головного мозку. Більш детально вивчена мікроскопічна структура серця, легенів, нирок та печінки. Вибір саме цих органів зумовлений їх активною участю в функціонуванні серцево-судинної системи та (для печінки і нирок) – в обміні ГЦ. Дослідження тварин з ГМГ виявило наявність суттєвих ушкоджень судинного русла, ознак гемоциркуляторних розладів та альтеративних змін паренхіми окремих органів, вірогідно гіпоксичного та метаболічного генезу.
В міокарді тварин з ГМГ просвіт інтрамуральних судин розширений, заповнений кров’ю, в частині артерій середнього та малого калібру і вен відмічаються ознаки ушкодження стінки у вигляді набряку ендотеліоцитів та плазматичного просочення медії, стази та тромбози, які, за даними гістохімічного дослідження, відповідають давнині утворення 18-24 години та більше. В окремих місцях кардіоміоцити мають ознаки вогнищевих, переважно зворотних, сегментарних та субсегментарних контрактурних змін I – III ступеня (рис.2).
У тварин, яких лікували ВМК та ПП-1, вже через 10 діб відмічались позитивні зрушення структури міокарду, головне – не знайдені артеріальні та венозні тромбози. Разом з тим залишкові зміни були більш вираженими за лікування ПП-1. 20-ти добове лікування в обох випадках практично повністю нормалізувало структуру міокарду. При 10-добовому лікуванні тварин з ГМГ за допомогою ОД гістопатологічні зміни не зменшились, навіть відбулось їх наростання, а через 20 діб у таких тварин в міокарді спостерігались вже незворотні зміни (рис 3). Ці дані свідчать про те, що повноцінна дієта (ОД) є недостатнім фактором для лікування синдрому ГГЦ.
В легенях тварин з експериментальною ГМГ на 15 добу спостереження відмічаються судинні порушення без ознак ушкодження паренхіми. В міжальвеолярних перетинках судини повнокровні, в частині артеріальних та венозних судин відмічаються стази і тромбози. Стінка окремих артерій потовщена, клітини м’язевої оболонки її набряклі, ендотеліоцити місцями розташовані частоколом, частина з них збільшена в розмірах, набрякла. Певні гістологічні зрушення за ГМГ відбуваються також в структурі бронхіального дерева, міжальвеолярних перетинках, нервових та лімфатичних утвореннях легень (рис.4).
Лікування ВМК та ПП-1 протягом 10 діб виявилось досить ефективним: за введення ВМК структура легень практично не відрізнялась від норми, а після лікування ПП-1 мікроскопічна картина лише незначно відрізнялася від контролю. Лікування тварин ОД було менш ефективним: тільки через 20 діб мікроскопічна структура легенів щурів набула нормального вигляду.
В нирках за ГМГ відмічені такі зміни. Клубочки приблизно однакових розмірів, повнокровні, базальна мембрана їх капілярів тонка, в отворах мікросудин знаходиться значна кількість еритроцитів. Стінка окремих артерій набрякла, потовщена, отвір артеріальних судин розширений, переповнений кров’ю, в деяких артеріальних та венозних судинах виявлено тромби, “вік” яких становить 18-24 години та більше. Епітеліальні клітини проксимальних звивистих канальців мають ознаки розповсюджених виражених дистрофічних змін, відмічаються окремі вогнища некрозу (рис. 5). Вказані відхилення, індуковані в нирках за ГМГ, близькі до тих що описані в
Через 10 діб лікування ВМК мікроскопічна будова нирок практично не відрізнялась від контролю, а у тварин, що лікувалися препаратом ПП-1 – майже нормалізувалася: спостерігались незначний мезангіальний набряк та залишкові дегенеративні процеси у канальцевому епітелії. Через 20 діб лікування тварин з ГМГ введенням ВМК та ПП-1 будова нирок не відрізнялася від контролю. При застосування ОД явні патологічні зміни в нирках відмічалися навіть через 20 діб лікування.
В печінці щурів, крім ознак ушкодження стінки поодиноких судин з периваскулярною вогнищевою лейкоцитарною інфільтрацією, відмічались виражена розповсюджена альтерація гепатоцитів, що мала характер як стеатозу та дистрофічних змін, так і окремих вогнищ переважно моноцелюлярного некрозу. Місцями спостерігалось венозне повнокрів’я печінки, фіброз та склероз міжчасточкових перегородок. Поряд з жировою дистрофією в окремих гепатоцитах відмічались ознаки гіаліновокраплинної дистрофії у вигляді брилуватих та сітчастих еозинофільних включень у цитоплазмі.
Лікування тварин з ГМГ введенням ВМК та ПП-1 виявилось доволі ефективним: вже через 10 діб під дією ВМК структура печінки практично не відрізнялася від такої у тварин з груп інтактного контролю, в той час як після лікування ПП-1 збереглися незначні відхилення. Позитивний лікувальний вплив ВМК був виявлений при дослідженні і інших органів.
ВИСНОВКИ
В дисертаційній роботі експериментально обгрунтовується доцільність застосування нового вітамінно-мікроелементного комплексу для профілактики та лікування гіпергомоцистеїнемії.
1. У білих нелінійних щурів з гострою та хронічною моделлю ГГЦ, викликаною введенням L-метіоніну, так само, як і з гіповітамінозно-метіоніновою моделлю, реєструється значне підвищення рівню гомоцистеїну (в 4,5-5,1; 2,2; 11-13 разів, відповідно) в плазмі крові, виникають явища оксидативного стресу – вміст малонового діальдегіду в крові, печінці та нирках підвищується на 65,8; 57,0; 20%, відповідно, кетогруп білків на 57,6; 84,8; 46,7%, відповідно, гідропероксидів в печінці на 37,8%, в нирках – на 40,8%. За гіповітамінозно-метіонінової ГГЦ формується ендотоксикоз – рівень молекул середньої маси в крові підвищується на 53,6%.
2. На моделі гострої ГГЦ, викликаної L-метіоніном, 10-добове внутрішньошлункове введення щурам ВМК значно зменшувало рівень гомоцистеїну в плазмі крові (2,86±0,26 мкг/мл, в контролі ГГЦ – 8,26±1,53 мкг/мл). За цим показником ВМК вірогідно переважав препарат порівняння ПП-2 (3,86±0,32 мкг/мл) та дорівнював ПП-1.
3. Лікувально-профілактичне введення білим щурам з моделлю хронічної метіонінової ГГЦ вітамінно-мікроелементного комплексу протягом 15 діб практично нормалізувало рівень гомоцистеїну (знизився з 3,70±0,30 мкг/мл до 1,87±0,23 мкг/мл), а також зменшувало вміст малонового діальдегіду в сироватці крові (з 17,80±0,95 до 13,20±0,88 мкмоль/л) і кетогруп білків (з 60,3±2,5 до 42,8±2,0 мкг/100мг білка). За двома останніми ефектами ВМК вірогідно переважав ПП-1 (15,90±0,74 мкмоль/л та 55,3±2,6 мкг/100мг білка, відповідно) і дорівнював ПП-2.
4. В умовах сформованої хронічної метіонінової ГГЦ щодобове внутрішньошлункове введення ВМК протягом 3 діб нормалізувало вміст гомоцистеїну в плазмі крові білих щурів (1,44±0,19 мкг/мл), малонового діальдегіду (14,20±0,83 мкмоль/л) та кетогруп білків (50,5±2,5 мкг/100 мг білка) в сироватці крові. Дія ВМК була тотожною такій ПП-2 та переважала ефект ПП-1 (за рівнем малонового діальдегіду та кетогруп білків).
5. На моделі гіповітамінозно-метіонінової ГГЦ щодобове введення ВМК протягом 4 діб нормалізувало вміст гомоцистеїну в плазмі крові білих щурів (рівень знизився з 19,20±2,60 до 0,86±0,12 ), а після дії ПП-1 – до 1,58±0,21 (при 1,43±0,26 мкг/мл у інтактних тварин). Препарат порівняння ПП-2 нормалізував цей показник лише на 10 добу.
6. Застосування ВМК у білих щурів з гіповітамінозно-метіоніновою ГГЦ на 4 добу нормалізувало вміст молекул середньої маси (рівень зменшився з 0,424±0,016 до 0,276±0,020 од), а на 10 добу – рівень малонового діальдегіду, кетогруп білків, гідроперекисів в сироватці крові, печінці та нирках. За цими показниками ВМК дорівнював ПП-2 та вірогідно перевищував ПП-1.
7. У білих щурів з гіповітамінозно-метіоніновою ГГЦ реєструються морфологічні ознаки ушкодження судинного русла (повнокрів’я, набухання стінки судин, десквамація ендотелію, тромбоз окремих судин різної давнини та інші), паренхіми печінки та нирок гіпоксичного та метаболічного характеру (дистрофія, стеатоз, гломерулосклероз та інші). Лікування ВМК при цій патології відновлює структуру судин та органів на 10 добу, а при використанні ПП-1 на 20 добу.
8. Механізм лікувально-профілактичної дії ВМК, ймовірно, обумовлений в першу чергу зниженням в плазмі крові ГЦ за рахунок прискорення його метаболізму під впливом вітамінів та мікроелементів.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. За механізмом дії сучасні засоби лікування ГГЦ доцільно поділити на 4 групи: а) прямої гіпогомоцистеїнемічної дії (активують обмін ГЦ чи сприяють екскреції його з сечею); б) з опосередкованою гіпогомоцистеїнемічною активністю (знижують потребу в S-аденозилметіоніні або мають нез’ясований механізм впливу); в) засоби, дія яких спрямована на корекцію ускладнень, викликаних ГГЦ; г) комбіновані препарати, що в одній лікарській формі містять речовини з різним механізмом дії.
2. При станах, що супроводжуються підвищеним вмістом гомоцистеїну в плазмі крові, з лікувальною метою слід застосовувати новий вітамінно-мікроелементний комплекс (вітаміни В6 , В9 , В12, цинк, хром, ванадій).
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Пентюк О.О., Луцюк М.Б., Постовітенко К.П., Артемчук М.А., Асачова О.С., Призимирська Т.В. Гіпергомоцистеїнемія: моделювання та вплив на стан судинної системи в експерименті // Досягнення біології та медицини. - 2004. – Т.3, №1. - С.35-38. (Здобувач провів експериментальні дослідження на моделі хронічної ГГЦ, статистичну обробку отриманих результатів, написав висновки).
2. Постовітенко К.П., Пентюк О.О., Луцюк М.Б., Призимирська Т.В., Артемчук М.А., Андрушко І.І., Чехун В.Ф., Чорнопищук О.Л. Біохімічні зміни в крові, печінці та нирках при експериментальній гіпергомоцистеїнемії за її лікування вітамінами та вітамінно-мінеральним комплексом // Вісник Вінницького національного медичного університету. - 2005. - Т.9, №2. - С.222-227. (Здобувач провів випробовування ВМК на моделі гіповітамінозно-метіонінової ГГЦ та узагальнив результати).
3. Постовітенко К.П., Пентюк О.О., Луцюк М.Б., Сергієнко О.В., Артемчук М.А., Андрушко І.І., Харковенко Р.В., Чехун В.Ф., Призимирська Т.В. Морфологічні зміни в органах тварин з експериментальною гіпергомоцистеїнемією та можливість їх корекції дієтами, збагаченими вітамінами // Вісник морфології. - 2005. - Т.11, №2. - С.287-291. (Здобувач провів морфологічні дослідження та визначив статус вітамінів В6 , В9 , В12 ).
4. Артемчук М.А. Профілактично-лікувальна дія вітамінних та вітамінно-мікроелементних препаратів за гострої і хронічної метіонінової гіпергомоцистеїнемії // Biomedical and Biosocial Anthropology. - 2006. - Т.7. - С. 17-20.
5. Артемчук М.А. Синдром гіпергомоцистеїнемії – принципи лікування та підходи до класифікації гіпогомоцистеїнемічних лікарських препаратів, засновані на аналізі механізму
8-09-2015, 21:58
