Отже, отримані результати дозволяють припустити, що при хронічному гіперімунокомплексному процесі пониження синтезу оксиду азоту в активованих лімфоцитах прямо або опосередковано призводить до зміни в процесах його синтезу у ендотеліальних клітинах, що в подальшому може призвести до порушення функціональної здатності ендотелію та ушкодження судин. Гальмування фізіологічної регуляторної функції оксиду азоту при хронічній гіперімунокомплексемії створює умови для інгібування NO-синтазного шляху і веде до активації аргіназного шляху метаболізму L-аргініну.
Для з’ясування особливостей дії корвітину на два шляхи метаболізму NO в умовах in vitro дослідження проведено, як у контрольній групі тварин, так і у тварин із змодельованим хронічним гіперімунокомплексним процесом.
Присутність корвітину в інкубаційному середовищі інкубованих лімфоцитів та ендотеліоцитів інтактних тварин призвела до пониження у лімфоцитах рівня іNOS (Р<0,05), NO2 Ї(Р<0,05) та вмісту GSNO (Р<0,05). За даних умов прослідковується тенденція до зростання показників: NOS (Р<0,05), сNOS (Р<0,05) та NO3 Ї (Р<0,05). Присутність корвітину інгібувала активність аргінази у лімфоцитах в 2,4 раза (Р<0,05), вміст сечовини за цих умов не змінився. Аналогічні дослідження, проведені в ендотеліоцитах інтактних тварин, не виявили вірогідних змін у показниках метаболізму L-аргініну.
Додавання корвітину до інкубаційної суміші клітин за умов хронічної гіперімунокомплексемії виявило його коригуючий вплив на процеси синтезу оксиду азоту.
Так, наявність корвітину призвела до зниження активності іNOS (Р<0,05), активація якої спостерігалась за умов інкубації лімфоцитів з ендотеліоцитами при хронічній гіперімунокомплексемії. Паралельно підвищився вміст сNOS та рівень стабільних метаболітів у лімфоцитах (Р<0,05), інгібована активність аргінази (Р<0,05) та вміст сечовини (Р<0,05). Виявлено також виражений нормалізуючий ефект корвітину на функціональну активність ендотеліоцитів, що проявилося зниженням активності індуцибельної NO-синтази (Р<0,05), пониженням рівнів NO2 Ї (Р<0,05)і NO3 Ї (Р<0,05)та вмісту GSNO (Р<0,05). Активність аргінази за даних умов понизилась у 2 рази (Р<0,05), що навіть перевищує показник контролю в 1,6 раза (Р<0,05), вміст сечовини також зменшився у 3,4 раза (Р<0,05).
Отже, отримані експериментальні дані свідчать, що в умовах in vitro протекторні особливості водорозчинної форми корвітину пов’язані, перш за все, із його здатністю специфічно пригнічувати активність індуцибельної NO-синтази, без інгібування активності її конститутивної ізоформи в лімфоцитах і, особливо, в ендотеліальних клітинах за умов хронічної гіперімунокомплексної патології. Ця селективна властивість корвітину, за умов даного захворювання, проявляється також інгібуванням аргіназної активності і позитивною зміною неокисного шляху метаболізму L-аргініну на окисний.
Результати, отримані в умовах in vitro, стали основою для подальшого дослідження in vivo.
Розвиток хронічної гіперімунокомплексемії в цих умовах супроводжується значними змінами імунологічних показників. У всіх дослідних тварин встановлено вірогідне зростання рівня ЦІК (Р<0,01) різної молекулярної маси. Високий рівень ЦІК можна пояснити виснаженням захоплювальної здатності фагоцитів впродовж 12 тижнів досліду. Підтримання хронічної персистенції ЦІК у судинному руслі може також бути результатом недостатньої активності рецепторів мембран еритроцитів, які є основними їх носіями до “кліренсних” органів (Stokol T. et al., 2004). За участю цього механізму вони елімінуються фагоцитарною системою (Дрюк Н.Н., 2002; Якобісяк М., 2004). При надмірному утворенні ЦІК ця система може не спрацьовувати, і вони починають проявляти патогенну дію по відношенню до клітин-мішеней. Підтвердженням порушення функцій мембран цих клітин свідчать роботи (Чоп’як В.В., 1998; Соловьев А.И., 2003; Jancar S., 2005). Крім того, це комплексоутворення є комплементзалежним (Р<0,05), оскільки в умовах довготривалої імунної відповіді склад імунних комплексів поповнюється новими антитілами, що створює умови для їх фіксації та активації системи комплементу. Активація системи комплементу також корелює із гіперпродукцією оксиду азоту, наслідком чого, можливо, є збільшення на поверхні ендотеліоцитів генів, які кодують хемокіни – ІЛ-8, МСР-1, RANTES (Sen C.K., 1996; Чоп’як В.В., 2004).
Зменшення показника гемолітичної активності сироватки крові при хронічній гіперімунокомплексемії може свідчити про посилене використання компонентів системи комплементу для зв’язування ЦІК з клітинами. За цих умов особливо страждає кілінгова функція фагоцитів, сприяючи накопиченню ЦІК на клітинах-мішенях, а також їх преципітації в судинному мікроциркуляторному руслі (Malinski T., 2004).
Перед тим, як застосувати корвітин для корекції порушень імунологічних показників у тварин із хронічним гіперімунокомплексним процесом, ми поставили за мету дослідити його вплив на інтактний організм. Таке дослідження дозволяє виявити вплив препарату на імунологічну та неспецифічну реактивність організму, чутливість окремих ланок імунної системи до його дії, а також виключити можливий дисрегуляторний ефект на механізм імунної відповіді.
Як свідчать результати проведених досліджень, показники ЦІК у сироватці крові інтактних тварин після введення корвітину достовірно знижуються (Р<0,001). За цих умов рівні ЦІК – великих, середніх та малих розмірів – зменшуються. Вивчення впливу корвітину на імунологічні показники інтактних тварин виявило, що даний препарат знижує рівні ЦІК усіх розмірів та показник гемолітичної активності сироватки крові, що може свідчити про підвищення елімінації ЦІК з кровоплину фагоцитуючими клітинами.
Результат оцінки впливу препарату на визначення вмісту ЦІК у сироватці крові щурів за умов імунокомплексної патології показав пониження рівня великих (Р<0,05), середніх (Р<0,05) і малих (Р<0,05) ЦІК та нормалізацію активності системи комплементу (Р<0,05), що свідчить про посилення механізмів фагоцитозу.
Відомо, що імунокомплексне ураження тканин прямо чи опосередковано пов’язано із змінами в метаболізмі оксиду азоту (Uesugi M., 1998). Отримані експериментальні дані показали, що розвиток хронічної гіперімунокомплексемії супроводжується експресією індуцибельної NO-синтази, активність якої в лімфоцитах зросла у 4,7 раза (Р<0,001), а в клітинах ендотелію у 2 рази (Р<0,01). Потенціал конститутивної NO-синтази за цих умов зазнає інгібування – на 61,6% (Р<0,001) в лімфоцитах (рис.1) та на 36,9% (Р<0,05) у ендотеліоцитах (рис.2).
Зміна показників ферментативної активності NOS супроводжуються підвищенням метаболізму аргіназного шляху NO: активність аргінази в лімфоцитах (рис.1) зросла у 5,1 раза (Р<0,001), вміст сечовини – 3,9 раза (Р<0,001); в ендотеліоцитах (рис.2) зміни в синтезі оксиду азоту є менш значними – активність аргінази зросла в 1,6 раза (Р<0,001), вміст сечовини – 1,9 раза (Р<0,001). Можливо, підвищення рівня сечовини у клітинах, при зміні утилізації аргініну на неокисний шлях метаболізму, має компенсаторне значення, враховуючи її відому антиоксидантну роль (Коцюруба А.В., 2000; Aoyagi K., 2003).
Інгібування ферментативної активності NOS може бути зумовлено пониженням біодоступності запасів L-аргініну (Зенков Н.К., 2000; Корж А.Н., 2003), що в подальшому може призвести до порушення рівноваги між двома шляхами – окисним (NO-синтазним) і неокисним (аргіназним). Окрім цього, виявлені зміни в активності NO-синтаз, очевидно, можуть бути пов’язані із тим, що активовані імунними комплексами фагоцити індукують продукування прозапальних цитокінів, які є промоторами iNOS в імунокомпетентних клітинах (Li H., Forstermann U., 2000; Nishimura M., 2004; Nangaku M., 2005). Стійка активація прозапальних цитокінів може створювати сприятливі умови для розвитку автоімуноагресії та подальшого підтримання гіперімунокомплексемії (Чоп’як В.В. 1998; Setiady Y., 2004; Norman M., 2005).
Відомо також, що запальні цитокіни можуть діяти як тригери, що переключають синтез NO з конститутивної ізоформи на індуцибельну (Cattaruzza M. et al., 2003).
Введення корвітину інтактним тваринам показало, що його вплив на процеси синтезу оксиду азоту у лімфоцитах та ендотеліальних клітинах характеризується недостовірним підвищенням ферментативної активності NOS, сNOS та рівнів нітрит - і нітрат - аніонів. Вміст GSNO за цих умов зростає як у лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,05). Активність індуцибельної ізоформи NOS в лімфоцитах інгібована (Р<0,001), а у ендотеліоцитах зростання її показника є недостовірним. Дослідження впливу корвітину на активність аргінази і рівень сечовини у лімфоцитах та ендотеліальних клітинах інтактних тварин виявило незначне пониження їх вмісту лише у лімфоцитах (Р<0,01).
Дія корвітину на показники NO-синтазної активності за умов експериментального гіперімунокомплексного процесу мала наступні особливості: введення корвітину супроводжується зростанням сNOS в 2,6 раза у лімфоцитах (Р<0,001), де спостерігається відновлення активності цього ферменту до показників контролю та значним інгібуванням iNOS – на 60,08% (Р<0,001), проте це зменшення не було достатнім для нормалізації активності даного ферменту відносно контролю (рис.1); ферментативну активність NO-синтаз в клітинах ендотелію (рис.2) за цих умов характеризує підвищення активності сNOS, величина якої збільшилася в 2,4 раза (Р<0,001), паралельно із цим відзначено зниження активності іNOS – на 28,6% (Р>0,05). Дані величини NO-синтаз у ендотеліоцитах перевищили вихідний рівень контролю – сNOS у 1,5 раза (Р<0,05) та іNOS в 1,6 раза (Р<0,05).
Отримані експериментальні дані свідчать, що протекторні особливості водорозчинної форми кверцетину – корвітину, при даній патології пов’язані, перш за все, із його здатністю специфічно пригнічувати активність іNOS. На механізм впливу кверцетину щодо пониження активності ферменту індуцибельної NOS, як на транскрипційному, так і на посттрансляційному рівнях, шляхом інгібування експресії мРНК та пониження серії сигнальних інтрацелюлярних шляхів індуцибельної NOS вказували (Kim N.K. et al., 1999; Chen Y.C., Chakravorty M. et al., 2001).
Застосування корвітину на тлі імунокомплексної патології призвело до значних змін у показниках аргіназного шляху метаболізму NO: інгібування активності аргінази на 63,4% в лімфоцитах (Р<0,001) ), що перевищило у 1,9 раза (Р<0,001) рівень контролю, та більш суттєвого, на 83,4%, пониження вмісту сечовини (Р<0,001) (рис.1); помітно знизилась активність аргінази у ендотеліальних клітинах (рис.2), показник якої падає на 21,2%, що в 1,3 раза нижче вихідного рівня. Вміст сечовини у ендотеліоцитах за даних умов зменшився на 57,5% (Р<0,001).


Рис. 1. Показники активності синтазного і аргіназного шляхів метаболізму L-аргініну в лімфоцитах щурів за умов норми, хронічної гіперімунокомплексемії (ХГІК) та корекції корвітином.
Отже, протекторні властивості корвітину є важливим фактором впливу на синтез оксиду азоту. В умовах окисного стресу корвітин може виступати як інгібітор неокисного метаболізму L-аргініну за аргіназним шляхом, внаслідок чого нормалізується окисний метаболізм L-аргініну за NО-синтазним шляхом (Дрюк Н.Н., 2002).
Зміни у вмісті метаболітів оксиду азоту – NO2 Ї та NO3 Ї значною мірою можуть залежати від ферментативної активності NO-синтаз. Так, з підвищенням ферментативної активності iNOS за умов розвитку хронічного гіперімунокомплексного процесу понижується рівень стабільних метаболітів оксиду азоту, як у лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,001). Вміст нітрозоглутатіону за цих умов також суттєво понижений – на 89% у лімфоцитах (Р<0,001) та, на 91,2% в клітинах ендотелію (Р<0,001). Як відомо, концентрація стабільних метаболітів оксиду азоту – NO2 Ї і NO3 Ї має залежність від ступеня активності патологічного процесу (Заячківська О.С., 2006), тому зниження їх рівнів в імунокомпетентних клітинах, можливо, пов’язано з інтенсифікацією при цій патології пошкоджувальної дії активних форм кисню (Коцюруба А.В., 2000). Зменшення у лімфоцитах та ендотеліоцитах рівня нітрозоглутатіону на тлі даної патології, може бути розцінено як зниження системи антиоксидантного захисту.
Введення корвітину групі тварин із хронічною гіперімунокомплексемією супроводжується підвищенням рівня метаболітів NO2 Їі NO3 Ї, як в лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,001). Паралельно з цим відзначено зростання GSNO, особливо в ендотеліальних клітинах (Р<0,001).
Отже, виявлені ефекти корвітину можуть свідчити про те, що цей препарат гальмує надмірне утворення оксиду азоту і, таким чином, запобігає глибоким метаболічним порушенням у досліджуваних клітинах.
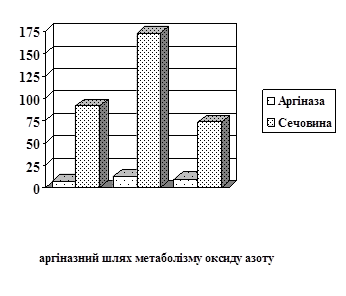
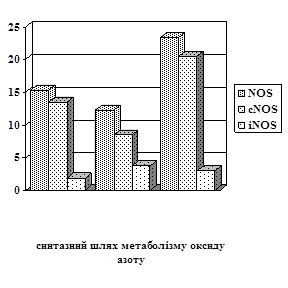
Рис. 2. Показники активності синтазного і аргіназного шляхів метаболізму L-аргініну в ендотеліоцитах щурів за умов норми, хронічної гіперімуно-комплексемії (ХГІК) та корекції корвітином.
Проведені дослідження виявили, що імунологічні та біохімічні порушення при хронічній гіперімунокомплексемії, супроводжуються морфологічними змінами в лімфоцитах та клітинах ендотелію. Електронно-мікроскопічні дослідження лімфоцитів тварин з хронічним імунокомплексним ураженням виявили виражену реакцію цих клітин на змодельований патологічний процес. Ця реакція характеризувалася переважанням деструктивних процесів: пошкодженням ультраструктури плазматичної мембрани і, навіть, її відсутністю в деяких місцях, безструктурним та неоднорідним цитоплазматичним матриксом, недиференційованими органелами, скупченням електроннощільного гранулярного матеріалу. Плазматична мембрана має множинні дефекти, а цитоплазматичній простір вільно сполучається з оточуючим інтерстицієм. Таким чином, проведені дослідження виявили, що хронічна гіперімунокомплексемія супроводжується деструктивними змінами із елементами початкового некрозу у ефекторних клітинах – лімфоцитах, що свідчить про їх безпосереднє залучення в розвиток патологічного процесу.
Введення корвітину тваринам із даною патологією супроводжувалось покращенням морфофункціонального стану цих клітин.
При дослідженні черевного відділу аорти тварин з хронічним гіперімунокомплексним процесом встановлено, що плазма крові насичена лапатими масами, гемолізованими еритроцитами, преципітатами та коагулятами. Виявлені зміни відображають порушення системи гемостазу (Мищенко В.П., 2003) та насичення при цьому плазми крові нетиповими тілами, які, можливо, мають імунокомплексну природу. Ендотеліальний шар аорти дослідних тварин у ряді місць був деендотелізований, на значних його ділянках представлений сплющеної форми дезорганізованими клітинами, плазматична мембрана яких була часто перерваною та вміщувала дрібні депозити. Отримані дані свідчать про глибокі пошкодження та вказують на значні альтеративні впливи, що ініційовані довготривалим введенням бичачого сироваткового альбуміну. Такі альтеруючі впливи на окремі ділянки внутрішньої оболонки призводять аж до некрозу та десквамації ендотеліальних клітин у просвіт артерії. На подібність морфологічних змін за умов довготривалого впливу на організм бичачого сироваткового альбуміну вказували (Lefkowith J.B., 1997). Електроннощільними депозитами був також насичений субендотеліальний шар та локальні ділянки базальної мембрани. Витягнутої форми депозити виявлялись по периферії внутрішньої еластичної мембрани. Виявлена нами присутність депозитів у плазматичній мембрані пошкоджених ендотеліальних клітин може свідчити про патогенну дію імунних комплексів, які утворюються у великій кількості за умов довготривалого введення бичачого сироваткового альбуміну. Присутність значної кількості депозитів в субендотеліальному шарі, на поверхнях внутрішньої еластичної мембрани та фенестрованих еластичних мембран стінки аорти цих тварин свідчить про глибоке проникнення та відкладання при цьому електроннощільних структур, що мають імунокомплексну природу.
Введення корвітину дослідним тваринам призвело не тільки до усунення деструктивних явищ у ендотеліальних клітинах, але подекуди і до повного відновлення морфологічної структури клітини. Такі ультраструктурні зміни клітин судинної стінки, за умов застосування корвітину, є істотним підтвердженням його цитопротекторного та ендотелійстабілізуючого впливу.
Отже, отримані нами дані підтверджують позитивний ендотеліопротекторний ефект корвітину за умов хронічної гіперімунокомплексної патології. Даний препарат, володіючи високою афінністю до ендотелію, нейтралізуючи активні форми кисню, сприяє репарації ультраструктурних ушкоджень ендотелію і навіть відновлює до норми морфологічні зміни. Застосування корвітину дозволить удосконалити фармакологічну корекцію вільнорадикальних процесів, які інтенсивно розвиваються за умов гіперімунокомплексної патології і призводять, в першу чергу, до ушкодження судин мікроциркуляторного русла.
ВИСНОВКИ
У дисертаційній роботі наведені нові теоретичні узагальнення результатів дослідження особливостей метаболізму L-аргініну та його зв’язку з лімфоцитарно-ендотеліальними асоціаціями за умов норми та хронічної гіперімунокомплексної патології. Описані ультраструктурні особливості цих клітин і запропоновано нові підходи до корекції порушень, зумовлених хронічним гіперімунокомплексним процесом, за допомогою корвітину. В результаті вирішення наукового завдання зроблено наступні висновки:
1. Розвиток хронічної гіперімунокомплексемії підтверджується зростанням показників ЦІК різної молекулярної маси та зниженням показника гемолітичної активності комплементу.
2. Аналіз кооперативної взаємодії лімфоцитів та клітин ендотелію у тварин із хронічною гіперімунокомплексемією показав зниження активності сNOS в лімфоцитах – 2,2 раза і в ендотеліальних клітинах – 1,3 раза із одночасним наростанням активності іNOS у цих клітинах: в лімфоцитах – 4 рази та ендотеліоцитах – 1 раз. Паралельно виявлена активація аргінази і підвищення вмісту сечовини, що більше виражено у лімфоцитах.
3. Розвиток хронічної гіперімунокомплексемії супроводжують наступні зміни метаболізму NO-синтазного шляху: зростання активності iNOS у лімфоцитах – 4,7 раза, в ендотеліоцитах в 2 рази та інгібування потенціалу cNOS у лімфоцитах-2,6 раза і в 1,6 раза в ендотеліоцитах.
4. Хронічний гіперімунокомплексний процес характеризується зростанням показників аргіназного шляху метаболізму L-аргініну: активність аргінази у лімфоцитах підвищується у 5,1 раза, в ендотеліоцитах в 1,6 раза; вміст сечовини у лімфоцитах збільшується у 3,9 раза, в ендотеліоцитах – 1,9 раза.
5. Розвиток хронічної гіперімунокомплексемії зумовив пониження рівнів нітрат- і нітрит – аніонів як в лімфоцитах, так і в клітинах ендотелію. Ці зміни (більш виражені у лімфоцитах) можна розцінити як розвиток нітрозактивного стресу в досліджуваних клітинах. Зменшення вмісту нітрозоглутатіону (також більш виражене в лімфоцитах) свідчить про пониження системи антиоксидантного захисту за цих умов.
6. Хронічний гіперімунокомплексний процес супроводжується порушенням морфофункціонального стану лімфоцитів та ендотеліоцитів. Зміни в лімфоцитах характеризуються переважанням деструктивних процесів із елементами початкового некрозу. Морфологічні дослідження стінки аорти білих щурів виявляють значні порушення ендотеліального шару судинної стінки внаслідок відкладання імунних комплексів.
7. Застосування корвітину, на тлі хронічної гіперімунокомплексемії, призвело до зниження концентрації ЦІК різної молекулярної маси та зростання показників комплементарної активності сироватки крові.
8. Корвітин в умовах in vitro, проявляючи інгібуючий вплив на активність іNOS та вміст аргінази і сечовини, як в лімфоцитах так і в ендотеліоцитах, не впливає при цьому на активність cNOS, що підтверджує
8-09-2015, 22:21
