Серед багатьох пластинчастих тілець спостерігаються нерівномірні світлі проміжки між бімембранними осмієфільними пластинами. Разом з тим, зустрічаються альвеолоцити ІІ типу в стані підвищеної функціональної активності. Порушення субмікроскопічної будови значної частини альвеолоцитів ІІ типу відображається на стані поверхневої активності сурфактанту, яка знижена, про що свідчить збільшення мінімального і максимального поверхневого натягу (Р<0,001) та зменшення індексу стабільності (Р<0,001).
У просвіті альвеол визначається збільшення кількості альвеолярних макрофагів. Очевидно, це можна розцінити як первинну реакцію даних клітин у відповідь на альтерацію легеневої тканини.
Морфометричні дані об'ємної щільності альвеол, строми, пошкоджених ділянок, непошкоджених ділянок легень та товщини міжальвеолярних перетинок в динаміці розвитку високої обтураційної ГКН показали значні достовірні зміни в порівнянні з контрольними даними та з кожним строком експерименту (табл. 1).
Відносний об'єм альвеол (ВОА) почав достовірно змінюватись уже в 2 контрольній групі тварин. Відмічено достовірне зменшення ВОА на 10,9 %. У дослідній групі через добу після створення моделі високої обтураційної ГКН відносний об'єм альвеол зменшувався в порівняні з першою контрольною групою на 42,9 %, в порівняні з другою контрольною групою на 28,9 %. На другу добу ВОА не мав статистично значимих відмінностей порівняно з першою добою експерименту. На третю добу відмічено значне на 58,1 % (P<0,001) зниження ВОА в порівняні з першою контрольною групою та на 42,6 % в порівняні з другою контрольною групою. В подальшому ВОА прогресивно зменшувався: на четверту добу - на 75,5 % зменшувався в порівняні з першою контрольною групою та на 58,2 % в порівняні з другою контрольною групою, на п’яту добу - на 127,8 % в порівняні з першою контрольною групою та на 105,4 % в порівняні з другою контрольною групою.
Таблиця 1
Об'ємна щільність альвеол, строми, пошкоджених ділянок, непошкоджених ділянок легень та товщина міжальвеолярної перетинки в динаміці розвитку високої обтураційної ГКН (M±s)
| ВОА (ум.од.) | ВОС (ум.од.) | TMП (мкм) | ВОПД(ум.од.) | ВОНД(ум.од.) | |
| Контр.1 | 0,672±0,041 | 0,328±0,041 | 1,604±0,276 | 0,095±0,036 | 0,905±0,036 |
| Контр.2 | 0,606±0,046** | 0,394±0,046** | 1,640±0,197** | 0,157±0,048** | 0,843±0,048** |
| 1 доба ВОГКН | 0,470±0,101** | 0,530±0,101** | 1,890±0,439** | 0,374±0,064** | 0,626±0,064** |
| 2 доба ВОГКН | 0,472±0,129 | 0,528±0,129 | 2,268±0,477* | 0,479±0,101** | 0,521±0,101** |
| 3 доба ВОГКН | 0,425±0,151* | 0,575±0,151* | 2,886±0,661** | 0,550±0,123** | 0,450±0,123** |
| 4 доба ВОГКН | 0,383±0,143* | 0,617±0,143* | 3,163±0,860* | 0,656±0,151** | 0,344±0,151** |
| 5 доба ВОГКН | 0,295±0,129** | 0,705±0,129** | 3,458±0,941* | 0,742±0,131** | 0,258±0,131** |
Примітка:
ВОА - відносний об'єм альвеол
ВОС - відносний об'єм строми
TMП - товщина міжальвеолярної перетинки
ВОПД - відносний об'єм пошкоджених ділянок
ВОНД - відносний об'єм непошкоджених ділянок
* - Р < 0,05 - достовірність різниці відносно групи попереднього строку ВОГКН.
** - Р < 0,001 - достовірність різниці відносно групи попереднього строку ВОГКН.
Відносний об'єм строми легень навпаки зростав. Спостерігається значне потовщення стінки дихальних бронхіол за рахунок просочення їх геморагічною рідиною. Товщина міжальвеолярних перегородок у зв’язку з їх набряком та інфільтрацією лейкоцитами та макрофагами зростала протягом всього строку спостереження (див. табл. 1).
Характерно, що збільшувалась об'ємна щільність пошкоджених ділянок легеневої тканини (ВОПД) з кожною добою після створення моделі високої обтураційної ГКН (див. табл. 1). Так уже на першу добу експерименту об'ємна щільність пошкоджених ділянок збільшувалась в 2,4 рази, на другу відповідно - в 3,05 рази, на третю - в 3,5 рази, на четверту - в 4,2 рази, на п’яту - в 4,7 рази в порівняні з другою контрольною групою (P<0,001). Об'ємна щільність непошкоджених ділянок легеневої тканини з кожною добою навпаки зменшувалась (див. табл. 1).
Як відомо, альвеолоцити II типу є сурфактантпродукуючими клітинними елементами. Тому переважання серед альвеолоцитів II типу клітин з дистрофічними та деструктивними ознаками повинно супроводжуватися пригніченням системи сурфактанту легень. Це припущення підтверджується даними скануючої електронної мікроскопії та результатами імуногістохімічних досліджень (Загорулько А.А., 2005). Вогнищеві спадання легень (частковий ателектаз або дистелектаз) пов’язані з порушенням утворення сурфактанту.
Дослідження поверхневої активності водно-сольових екстрактів легеневої тканини в динаміці високої обтураційної ГКН визначило виражені порушення функціональної активності СЛ.
Отримані дані доводять, що причиною розвитку структурних та функціональних змін легень при високій обтураційній ГКН є ендогенна інтоксикація, що зумовила токсичне пошкодження як судинного, так і респіраторного відділу легень. Встановлена взаємозалежність між показниками токсичності крові та показниками поверхневої активності екстрактів легеневої тканини в динаміці високої обтураційної ГКН. Концентрація молекул середньої маси в сироватці крові мала високий прямий корелятивний зв’язок з показником мінімального поверхневого натягу (r = 0,97) та показником максимального поверхневого натягу (r = 0,89), а з індексом стабільності Клементса - високий зворотний корелятивний зв’язок (r = - 0,94).
В нашому дослідженні після хірургічного відновлення прохідності тонкої кишки через 3 доби після створення моделі ГКН пошкодження легеневої тканини значно посилюються. Вони характеризуються переважанням альтеративних процесів над компенсаторно–пристосувальними реакціями. Істотно збільшується не тільки вираженість, але і поширеність патологічних процесів, про що свідчать морфологічні дані, відносний об`єм альвеол, щільності строми, площі пошкоджених і не пошкоджених ділянок легень і товщини міжальвеолярних перегородок (табл. 2).
Таблиця 2
Об'ємна щільність альвеол, строми, пошкоджених ділянок, непошкоджених ділянок легень та товщина міжальвеолярної перетинки після хірургічного лікування високої обтураційної ГКН (M±s)
| Контроль 2 | Перша доба після хірургічного лікування | Друга доба після хірургічного лікування | |
| ВОА (ум.од.) | 0,606±0,046 | 0,323±0,136** | 0,266±0,131** |
| ВОС (ум.од.) | 0,394±0,046 | 0,677±0,136** | 0,734±0,131** |
| TMП (мкм) | 1,640±0,197 | 3,493±0,955** | 3,753±0,960* |
| ВОПД (ум.од.) | 0,157±0,048 | 0,713±0,151** | 0,741±0,143* |
| ВОНД (ум.од.) | 0,843±0,048 | 0,287±0,151** | 0,259±0,143* |
Примітка: позначення та скорочення див. табл. 1.
В патогенезі виявлених змін лежать порушення мікроциркуляції, пошкодження ендотелію капілярів, мукоїдне набухання їх стінки та шунтування кровотоку. Циркуляційні розлади на фоні прогресуючої інтоксикації приводять до тканинного ацидозу та розладів гемокоагуляції типу дисемінованого внутрішньосудинного згортання (Чернов В.Н., Белик Б.М., Женило В.М., 2000).
При електронномікроскопічному дослідженні звертає на себе увагу поширене, прогресуюче порушення ультраструктури альвеолоцитів І, ІІ типів і альвеолярних макрофагів. У цитоплазмі альвеолоцитів І типу відмічається збільшення кількості мікропіноцитозних пухирців, з’являються вакуолі різних розмірів. Мітохондрії набряклі, з матриксом слабкої електроннооптичної щільності, кристи втрачають свою паралельність, кількість останніх зменшена. Поряд з розширеними елементами апарату Гольджі спостерігається фрагментація мембран гранулярної ендоплазматичної сітки. Ядра збільшені за розмірами, з каріоплазмою низької електронної щільності. У багатьох клітинах відмічаються вітрилоподібні випинання стоншеної частини альвеолоцитів І типу, направлені в просвіт альвеол.
Набряк поширюється і на альвеолоцити ІІ типу. Гіпергідратація даних клітин призводить до зниження їх функціональної активності, порушення синтезу і секреції сурфактанту легень. Це, в свою чергу, призводить до дефіциту сурфактанту легень на альвеолярній поверхні. Про значне зниження поверхнево-активних властивостей сурфактанту легень свідчить різке підвищення мінімального і максимального поверхневого натягу (Р<0,001) при одночасному зменшенні індексі стабільності (Р<0,001). Виражене пригнічення поверхневої активності сурфактанту легень ймовірно пов’язано як з порушеннями внутрішньоклітинного метаболізму сурфактанту або відбувається інактивація позаклітинного сурфактанту, або одне і друге разом. Виражене пригнічення поверхневої активності сурфактанту легень пов’язане також із деструкцією позаклітинного компоненту сурфактанту. Можливо, велике значення має інактивація альвеолярного сурфактанту білковими компонентами плазми крові, які потрапляють у просвіт альвеоли у зв’язку з підвищеною проникністю структурних компонентів аерогематичного бар’єру. Дефіцит поверхнево активної речовини на альвеолярній поверхні супроводжується розвитком дис- та ателектазів. Висока капілярна і клітинна проникність супроводжується наростанням ексудації і набряком основної речовини сполучної тканини стінки альвеоли, тобто розвитком інтерстиційного і в подальшому внутрішньоальвеолярного набряку.
Зміни у мікросередовищі альвеол негативно впливають на функціональну активність альвеолярних макрофагів. Як показали результати наших досліджень, серед макрофагальних елементів зустрічаються альвеолярні макрофаги із невеликою кількістю лізосом, але з великим числом фагосомних вакуолей, що вказує на функціональну неповноцінність фагоцитів.
При недостатності сурфактанту не всі ділянки легені розправляються. Формуються первинні ателектази. Унаслідок неповноцінної вентиляції розвиваються гіпоксія і ацидоз. Виникають рефлекторний спазм легеневих артеріол, набряк стінок альвеол, порушується проникність альвеолокапілярної мембрани. Останнє може привести до виходу плазми з легеневих капілярів з подальшим випаданням на поверхні дихальних бронхіол, альвеолярних проток і альвеол гіаліноподібних речовин і утворенням так званих гіалінових мембран. Гіалінові мембрани сприяють ще більшому зниженню синтезу сурфактанту і розвитку ателектазів легенів. При цьому посилюється гіпоксія, відбувається дисеміноване внутрішньосудинне згортання крові, з'являються набряки, крововиливи, кровоточивість. Все це приводить до ще більшого порушення синтезу сурфактанту, виникає так зване порочне коло (Martin T., 2000).
В нашому дослідженні при хірургічному лікуванні високої обтураційної ГКН іноді в стінках окремих дихальних бронхіол та альвеолах спостерігаються тонкі гомогенні смужки рожевого кольору, що є проявом синдрому гіалінових мембран. В просвітах альвеол виявляється серозно-фібринозний ексудат, вогнищево визначаються гіалінові мембрани. На цьому фоні спостерігаються крововиливи та ателектази. Виникають також порушення кровообігу, які проявляються передусім підвищеною проникністю стінок кровоносних судин. У результаті цього розвивається помірний набряк, який інколи поєднується з утворенням гіалінових мембран. За даними різних авторів (Луговской Э.В., 2003) у просвітах респіраторних відділів фібриноген перетворюється у фібрин, який створює структурну основу для формування гіалінових мембран. В умовах зниженої фібринолітичної спроможності легеневої тканини відбувається не лізис фібрину, а ущільнення його і білків плазми з утворенням гіалінових кілець, які тісно прилягають до стінок альвеол і альвеолярних ходів.
Лейкоцити, еритроцити та тромбоцити ексудату мають свій тромбопластин або тромбопластиноподібні речовини, які також трансформуються в протромбіназу. Під дією останньої в ексудаті швидко виникає тромбін, який конвертує фібриноген у фібрин-мономер. За участю іонів Са2+ переходить у фібрин-полімер. Останній під впливом плазмового фактора ХІІІ та тканинної фібринази перетворюється у фібрин (Луговской Э.В. и соавт., 2002). Патоморфологічні зміни неспецифічні, крім при високій обтураційній ГКН вони можуть спостерігатись при розвитку РДСД, радіаційних пошкодженнях, дії пестицидів та інших патологічних станах (Біктіміров В.В., Вернигородський С.В., 1998).
При хірургічному лікуванні високої обтураційної ГКН в умовах ентеродетоксикації сорбентом Силлард П на відміну від тварин другої серії відмічалось зменшення ділянок легеневої тканини з ознаками деформації та руйнування міжальвеолярних перегородок. Значно зменшились прояви інтерстиціального та внутрішньоальвеолярного набряку, а також зменшилась частота виявлення ділянок легеневої тканини з дис- і ателектазами у вигляді "зливних полів" та потовщеними міжальвеолярними перегородками. При цьому значно збільшилась частота виявлення ділянок легеневої тканини з витонченими міжальвеолярними перегородками без ознак їх пошкодження.
Оскільки четверта та п’ята доба після створення моделі високої обтураційної ГКН є критичними, такими, що визначають прогноз захворювання, нами детально проаналізовано для порівняння кожен морфометричний показник на цей строк у тварин трьох серій. При порівнянні показників ВОПД та ВОНД відмічено, що найбільше пошкоджених ділянок і найменше непошкоджених мали тварини першої та другої серій досліду на п’яту добу після створення моделі високої обтураційної ГКН. Найкращі показники ВОПД та ВОНД (рис. 1) були у тварин третьої серії досліду на п’яту добу (друга доба після хірургічного лікування з застосуванням ентеродетоксикації сорбентом Силлардом П).
Вже на другу добу після хірургічного лікування високої обтураційної ГКН з застосуванням ентеродетоксикації у тварин третьої серії дослідів відмічено достовірне збільшення ВОНД в 1,14 рази в порівнянні з першою добою лікування. На 30 добу після хірургічного лікування ВОНД збільшувався (P<0,001) в порівняні з першою добою в 1,70 рази, в порівняні з другою добою лікування в 1,49. Через 185 діб після хірургічного лікування високої обтураційної ГКН з застосуванням ентеродетоксикації у тварин третьої серії дослідів продовжувалось збільшення ВОНД в 1,13 рази в порівнянні з 30 добою та в 1,92 рази в порівняні з першою добою лікування. Через 365 діб лікування ВОНД збільшувався як в порівнювані першою добою в 1,97 рази. В порівнянні з 185 добою лікування збільшення ВОНД відмічено незначно (в 1,03 рази). При порівнянні з показниками другої контрольної групи різниця між показники ВОНД були нижчими в 1,15 рази. Це означає, що навіть через рік структура легень повністю не відновлюється. Як залишковий факт ураження легень через 365 діб після створення моделі високої обтураційної ГКН спостерігались локальні ділянки пневмосклерозу, які чергувались з ділянками легеневої тканини, в яких альвеоли мали збільшені розміри та витончені міжальвеолярні перегородки.
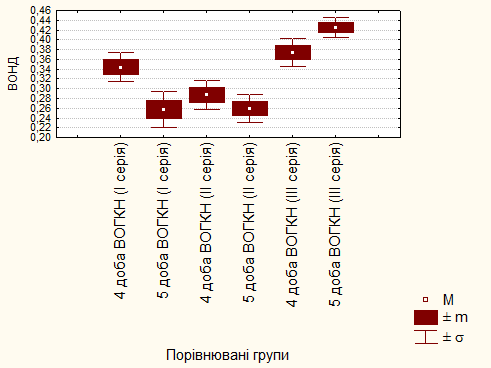
Рис. 1. Порівняння показників відносного об'єму непошкоджених ділянок легень на четверту та п’яту добу після створення моделі високої обтураційної ГКН у тварин трьох серій досліду.
При електронномікроскопічному дослідженні явища гіпергідратації у компонентах респіраторного відділу легень продовжують зберігатися, але меншою мірою виражені, ніж після хірургічного лікування без застосування сорбента. Рідше зустрічається альтерація альвеолоцитів І типу. Значно менша вираженість змін у вигляді внутрішньоклітинного набряку з порушенням ультраструктури відмічається в альвеолоцитах ІІ типу. Поряд з дистрофічно зміненими зустрічаються альвеолоцити ІІ типу з ознаками підвищеної функціональної активності. Інколи в таких активнофункціонуючих клітинах спостерігається секреція осміофільного матеріалу в просвіт альвеоли. Ймовірно вказані зміни направлені на підтримання знижених поверхнево-активних властивостей сурфактанту легень. Дане припущення підтверджують показники поверхневої активності сурфактанту легень, які мають тенденцію до збільшення, на що вказує зменшення мінімального та максимального поверхневого натягу (P < 0,001).
Повне відновлення поверхневої активності екстрактів легеневої тканини тварин третьої серії досліду спостерігалось на 180 добу післяопераційного періоду. ІС Клементса продовжував збільшуватись і варіював від 0,88 до 0,98 ум.од. Він достовірно не відрізнявся в порівнянні з показниками в контрольних тварин, був у 1,32 рази вищим, ніж у тварин до відновлення прохідності (3 доба високої обтураційної ГКН).
Альвеолярні макрофаги на даному етапі експерименту характеризуються морфо-функціональною неоднорідністю.Поряд з дистрофічно зміненими спостерігаються макрофагальні елементи з ознаками секреторної активності та фагоцитозу.
Можливості "зворотного розвитку" при пошкодженні легень зв’язані з інтенсивною проліферацією клітин з високим ступенем диференціації і функціональної спеціалізації в альвеолах - альвеолоцитів II типу. Встановлено, що при пошкодженні легені сприятливі до інтенсивного компенсаторного росту як на клітинному, так і субклітинному рівні. Механізми репаративної регенерації еволюційно основані на механізмах фізіологічної регенерації. Легені відносять до органів з повільною фізіологічною регенерацією, однак, клінічні спостереження та дані експериментальних досліджень вказують на те, що легеням притаманна висока компенсаторна спроможність (Серов В.В., Пауков В.С., 1995).
Таким чином, хірургічне лікування високої обтураційної ГКН в умовах значного зменшення ендогенної інтоксикації шляхом застосування ентеродетоксикації сорбентом Силлард П показало сереотипну динаміку структурних та ультраструктурних змін легень, значне поліпшення їх функції, що проявилося зростанням поверхневої активності сурфактанту легень.
Висновки
У дисертаційній роботі наведене теоретичне і нове рішення актуальної наукової задачі - встановлення впливу ендогенної інтоксикації на структурно-функціональні компоненти респіраторного відділу легень при високій обтураційній ГКН. В результаті комплексного дослідження виявлено характер ушкоджень легень, їх спрямованість, можливість їх попередження, тісний взаємозв'язок альтеративних процесів у легенях при високій обтураційній ГКН з ступенем ендотоксикозу.
1. В процесі розвитку високої обтураційної ГКН виявляються виражені структурні зміни в легенях, що проявилися на світлооптичному рівні поступовим зростанням вираженості альтеративних процесів (порушення мікроциркуляції, прогресуючий інтерстиційний набряк на тлі запалення легень, ділянки дис- та ателектазів, деформація та часткове руйнування міжальвеолярних перегородок) над компенсаторно-пристосувальними (ділянки легеневої тканини з витонченими міжальвеолярними перегородками, збільшеними розмірами порожнини альвеол без порушення їх структури). Гістологічні зміни співпадали з динамікою зростання товщини міжальвеолярних перегородок та відносного об'єму пошкоджених ділянок легень.
2. Висока обтураційна ГКН супроводжується ушкодженням структур респіраторного відділу легень, посиленим викидом альвеолоцитами ІІ типу осміофільного матеріалу в просвіт альвеол, як прояв компенсаторної реакції, набряком і локальною деструкцією цитоплазматичної мембрани альвеолоцитів I типу.
3. Після хірургічного лікування високої обтураційної ГКН прояви пошкодження легеневої тканини значно посилюються, та характеризуються переважанням альтеративних процесів, а їх глибина та розповсюдженість свідчить про можливість їх незворотності незворотного характеру (переважають ділянки ателектазів у вигляді зливних полів на тлі яких визначаються багаточисельні крововиливи; ділянки розпаду легеневої тканини, гіалінові мембрани, у просвіті альвеол накопичується фібрин у вигляді густої сітки, в петлях якої багато полінуклеарних лейкоцитів). Морфометричні дослідження підтверджують дані світлової мікроскопії.
4. Характер ультраструктурних змін паренхіматозних клітин легень експериментальних тварин, яким через три доби після створення моделі високої обтураційної ГКН проводили резекцію перев'язаної ділянки кишки, свідчить про мембранолітичну дію ендогенної інтоксикації та пов'язані з цим порушення білоксинтезуючої і фосфоліпідної функцій, а також окислювально-відновних процесів.
5. При хірургічному лікуванні високої обтураційної ГКН в умовах ентеродетоксикації на світловому рівні прояви пошкодження в аналогічні строки ВОГКН поступово зменшуються, а компенсаторно-пристосувальні- навпаки зростають,що підтверджується даними морфометрії. Ультраструктурні зміни респіраторного відділу легень також виражені менше, ніж після хірургічного лікування без застосування ентеродетоксикації. Посилюється синтетична та секреторна активність альвеолоцитів 2 типу. Виявляється зростання поверхневої активності сурфактанту легень. В післяопераційному періоді відбувається значне зниження ендогенної інтоксикації.
6. Найбільш значні порушення функціональної активності сурфактанту легень виявлені у тварин, яким через 72 години після створення моделі захворювання відновлювали прохідність тонкої кишки, про що свідчить різке підвищення мінімального поверхневого натягу вже через добу після відновлення прохідності тонкої кишки в 1,36 рази в порівнянні з передопераційним періодом та в 5,98 рази в порівнянні з контролем. Протягом другої доби констатовано зростання показника в 6,75 рази порівняно з контролем при одночасному зменшенні індексу стабільності Клементса з 0,91 ± 0,03 до 0,41 ± 0,03 (Р < 0,001).
7. Отримані дані доводять, що причиною розвитку структурних та функціональних змін легень є ендогенна інтоксикація, що зумовила токсичне пошкодження як судинного, так і респіраторного відділу легень. Встановлена кореляційна взаємозалежність між показниками токсичності крові та показниками поверхневої активності екстрактів легеневої тканини в динаміці високої обтураційної ГКН. Концентрація молекул середньої маси в сироватці крові мала високий прямий корелятивний зв’язок з показником мінімального поверхневого натягу (r
8-09-2015, 22:26
