h k - уровень кубовой жидкости, м;
G x1 , G k , G y0 - массовые расходы потоков в кубе колонны.
На основании (1) и (2) можно считать:
h k = f(G k ,G y0 ).
Предпочтительное управляющее воздействие Gk .
Материальный баланс по легколетучему компоненту.
Уравнение динамики:
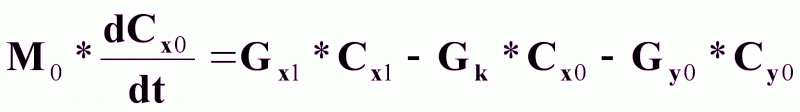 (3).
(3).
Уравнение статики:
G x1 C x1 = G k C к + G y0 C y0 (4)
Основные допущения:
Кипятильник с полным испарением, т.е. C y0=C x0;
Тепловой баланс кипятильника:
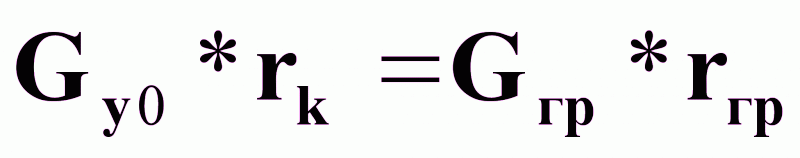
Обозначения:
М0 - масса жидкости в нижней части колонны, кг;
r гр - удельная теплота конденсации пара, дж/кг;
r k - удельная теплота испарения кубовой жидкости, дж/кг.
На основании (3) и (4) можно записать:
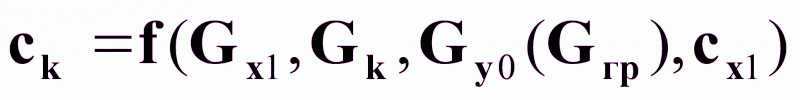 .
.
Предпочтительное управляющее воздействие Gгр .
Информационная схема низа колонны.
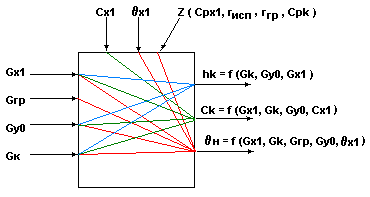
Рис.3.
Информационная схема низа колонны
как
многосвязного
объекта по hk,
 или hk,
Ck
.
или hk,
Ck
.
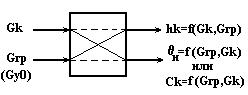
Рис.4
Математическое описание верха колонны.
Структурная схема дефлегматора с флегмовой емкостью.
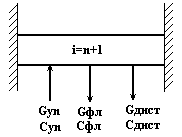
Рис.5.
Материальный баланс по всему веществу.
Уравнение динамики:
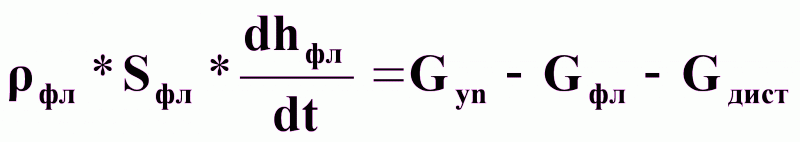 (7)
(7)
где фл - плотность флегмы , кг/м3 ;
Sфл - сечение флегмовой емкости , м2 ;
hфл - уровень флегмы , м;
Gyn, Gфл, Gдист - массовые расходы, кг/с.
Уравнение статики:
Gyn = Gфл + Gдист (8).
На основании (7) и (8) можно считать:
hфл=f(Gyn, Gфл, Gд )
Предпочтительное управляющее воздействие Gдист .
Материальный баланс по целевому компоненту.
Уравнение динамики:
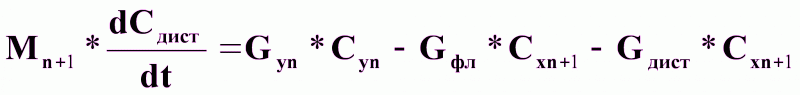 (9).
(9).
Уравнение статики:
Gyn Cyn = Gдист Cx n+1 + Gфл Cx n+1 (10).
На основании (9) и (10) можно считать:
Cдист=f(Gyn, Gфл, Gд )
Предпочтительное управляющее воздействие Gфл .
Тепловой баланс верха колонны ( в = н ).
Структурная схема n–ой тарелки
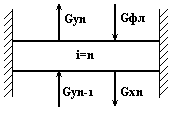
Рис.6.
Уравнение динамики:
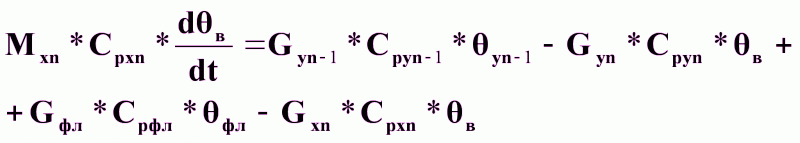 (11).
(11).
Уравнение статики:
Gyn-1*Cpyn-1 *yn-1 + Gфл*Cрфл *фл =
Gyn *Cpyn *в + Gxn *Cpxn *в (12).
Обозначения:
Мxn - масса паровой фазы наверху колонны;
Cpyn, Cpy,n-1, Cрфл, Cpxn - удельные теплоемкости паровой и жидкой фазы на n-ой тарелке;
Gyn-1, Gyn, Gxn - расходы паровой и жидкой фазы на n-ой тарелке.
На основании (11) и (12) можно считать:

Предпочтительное управляющее воздействие Gфл .
Баланс по паровой фазе.
Структурная схема конденсатора без флегмовой емкости.
Рис.7
Уравнение динамики:
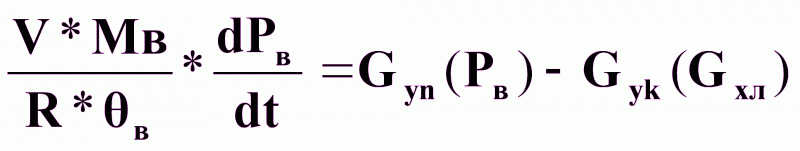 (13).
(13).
Уравнение статики:
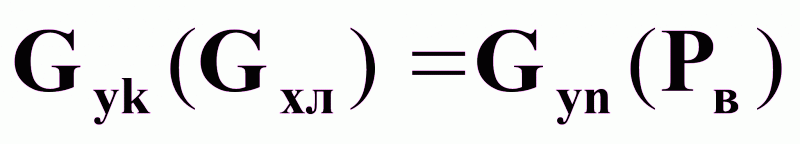 (14).
(14).
Особенности:
Решение уравнения динамики для pв дает выражение для интегрального звена.
Если учесть выражение Gyn = f (pв ), то звено получается апериодическим 1 порядка.
Gyк = f (Gхл ), можно получить на основании теплового баланса конденсатора:
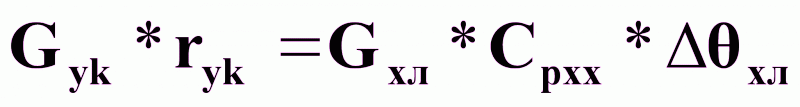 .
(15).
.
(15).
На основании (13), (14) и (15) можно принять:Pв =f(Gхл).
Информационная схема верха колонны.
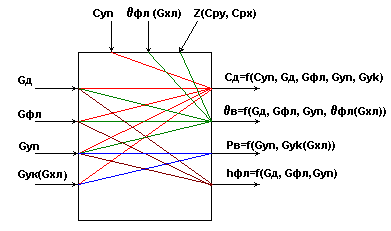
Рис.8.
Информационная схема верха колонны как многосвязного объекта по в и pв
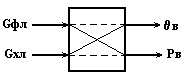
Рис.9а.
Информационная схема верха колонны как многосвязного объекта по hфл и в
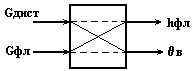
Рис.9б.
Информационная схема колонны как многосвязного объекта по в и н.
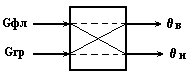
Рис.9в.
Математическое описание подогревателя потока питания.
Тепловой баланс
Уравнение динамики.
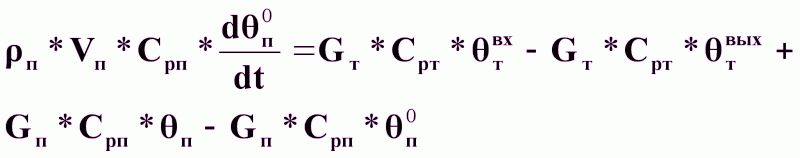 (16).
(16).
Уравнение статики.
Gт Cрт твх - Gт Cрт твых = Gп Cpп n0 - Gп Cpп n , (17)
Обозначения:
т вх ,т вых , n 0 ,n – температуры потоков теплоносителя и питания на входе и выходе из теплообменника;
Vn - объем потока питания в трубах теплообменника;
Cpп, Срт - удельные теплоемкости потоков питания и теплоносителя;
Gт, Gп - массовые расходы теплоносителя и питания, кг/ч.
На основании (16) и (17) можно считать:
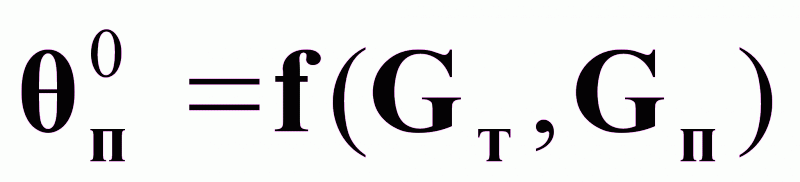 .
.
Предпочтительное управляющее воздействие Gт.
Информационная схема подогревателя потока питания
как объекта управления п0
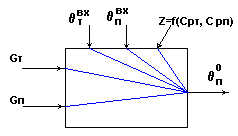
Рис.10.
Типовая схема автоматизации процесса ректификации.
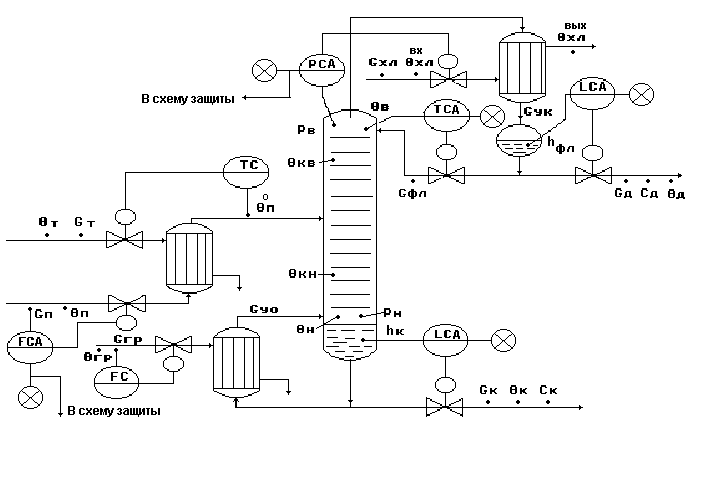
Рис.11.
Типовое решение автоматизации
процесса ректификации.
- Регулирование.
Регулирование θв=f(cд) по подаче флегмы - косвенное регулирование показателя эффективности процесса cд.
Регулирование Pв по подаче хладоагента Gхл - обеспечивает материальный баланс по паровой фазе.
Регулирование hфл по отбору флегмы Gфл - обеспечивает материальный баланс по жидкой фазе верха колонны.
Регулирование hк по отбору кубового продукта Gк - обеспечивает материальный баланс по жидкой фазе низа колонны.
Стабилизация расхода питания Gп - обеспечивает:
материальный баланс по всему веществу,
снятие наиболее существенных возмущений,
заданное положение рабочей области колонны;
стабилизацию производительности установки.
Стабилизация расхода греющего пара Gгр - обеспечивает:
тепловой баланс установки;
стабилизацию Gy0 .
Регулирование θп0 по подаче Gт обеспечивает:
заданное положение рабочей линии;
эффективность процесса разделения;
тепловой баланс
- Контроль.
Температуры и расходы всех исходных потоков.
Температуры - θв, θн, θкв, θкн, θп0.
Давление - Рв, Рн.
Уровень - hфл, hк.
Концентрации - сд или ск .
- Сигнализация.
существенные отклонения hфл, hк, θв от заданий:
повышение
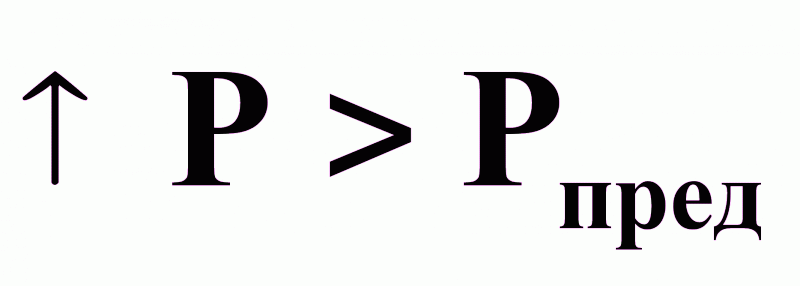 ;
;
резкое
снижение или
прекращение
подачи потока
питания
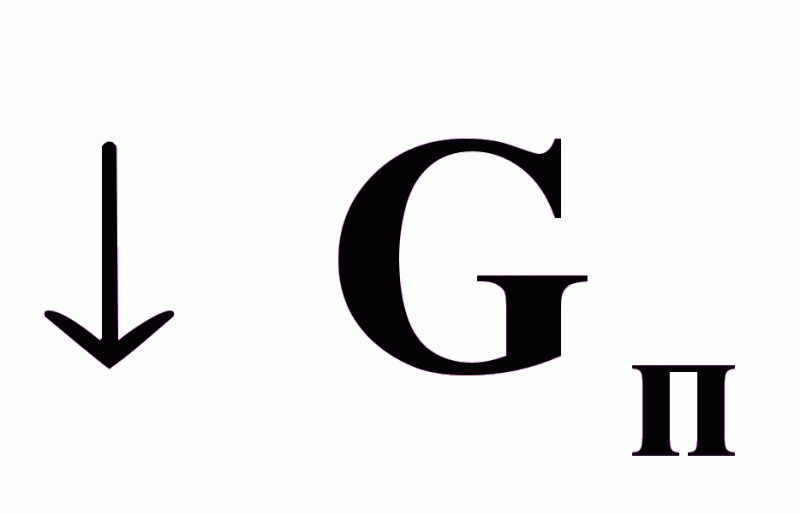 .
.
7. Материалы к лекции №15
Автоматизация реакторных процессов (ч.1)
Упрощенная структурная схема химического реактора.
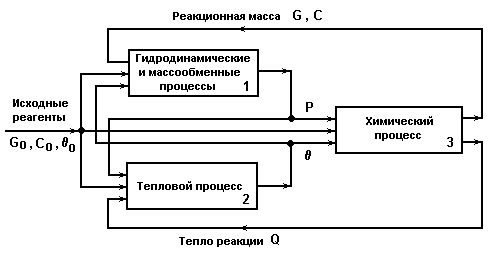
Рис.1.1.
Химический процесс (3) определяется:
уравнениями кинетики
взаимодействием гидродинамических, массообменных и тепловых процессов в аппарате,
от которых зависят концентрации реагентов, температура и давление Р реакторного процесса.
Химические превращения (3) приводят к изменению тепловых (2) и гидродинамических процессов (1) в реакторе.
Определение характера процессов, протекающих в реакторе, на основе анализа соотношения между скоростью химической реакции r и скоростью материального обмена rобм.
При
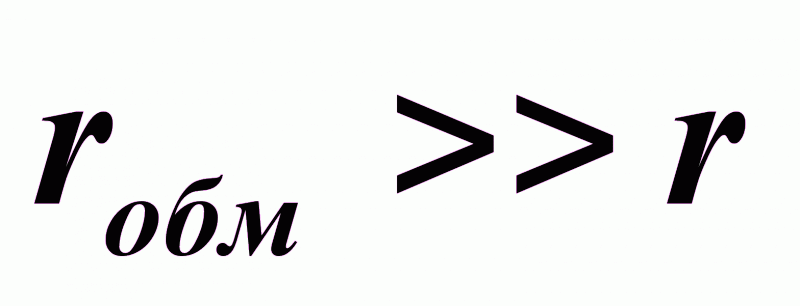 :
:
процесс идет в кинетической области;
скорость процесса определяет химическое взаимодействие;
массообмен не влияет на скорость химической реакции.
При
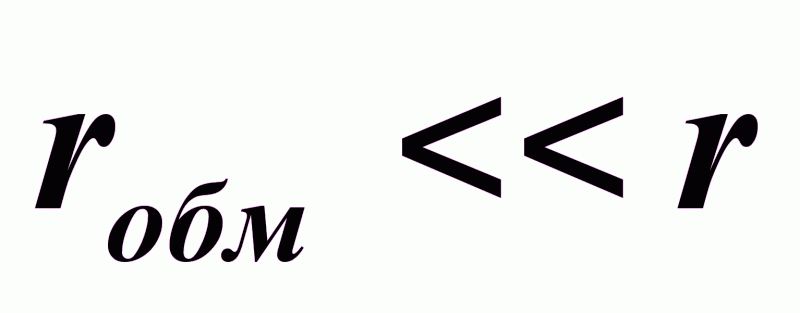 :
:
процесс идет в диффузионной области;
процесс характеризуется массообменом;
определяющей стадией является транспорт реагирующих веществ.
При
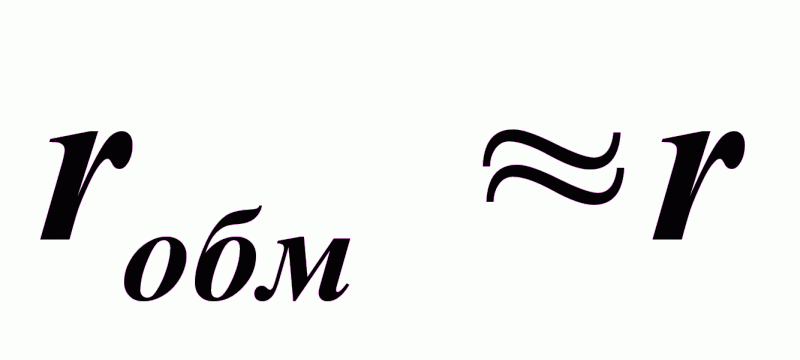 :
:
процесс идет в переходной области;
скорость процесса является сложной функцией реакционно-кинетических и диффузионных зависимостей.
Показатели эффективности реакторного процесса.
Степень превращения.
Степень превращения Un , представленная через мольные доли:
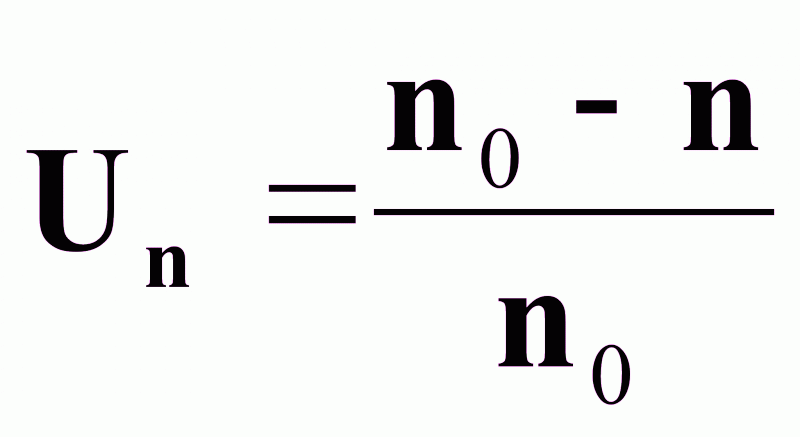 (1а),
(1а),
где n0 - число молей компонента в исходном потоке;
n - число молей компонента в реакционной смеси.
Степень превращения Um , представленная через массовые доли:
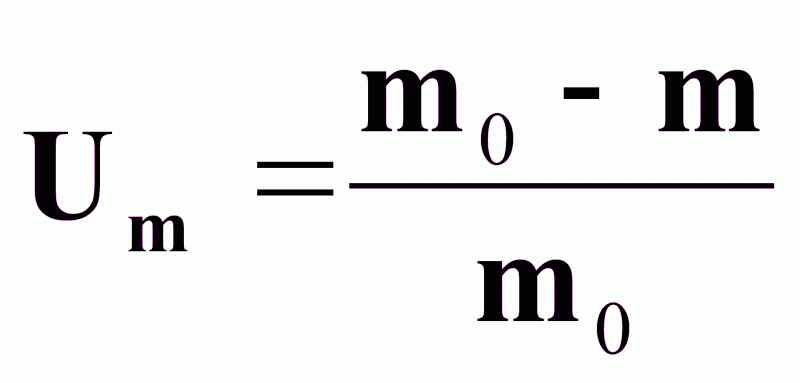 (1б),
(1б),
где m0 - масса компонента в исходном потоке;
m - масса компонента в реакционной смеси.
Факторы, влияющие на степень превращения:
и Р - температура и давление, влияют на смещение химического равновесия в реакции;
tр - продолжительность химической реакции;
С0 - концентрации исходных веществ;
подбор катализатора;
величина потока рециркуляции.
Выход продукта.
Определение выхода продукта Х:
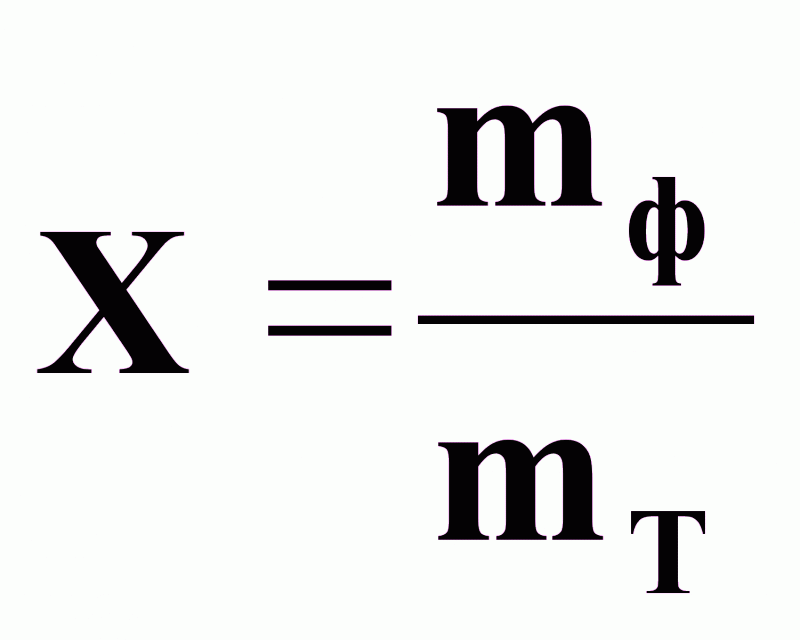 (2),
(2),
где
mф - масса фактически полученного продукта;
mт - масса теоретически возможного количества продукта из данного исходного вещества.
Факторы, влияющие на выход продукта Х:
θ - температура;
Р - давление;
Сi - состав реакционной смеси;
tпр - время пребывания реакционной смеси в аппарате.
Выход продукта характеризует:
степень совершенства технологического процесса: чем ближе Х 1, тем ближе расходные коэффициенты к стехиометрическим;
экономические показатели технологического процесса: чем ближе Х 1, тем лучше экономические показатели реакторного процесса.
Избирательность химического процесса.
Избирательность химического процесса Из характеризует долю исходных веществ, превращенных в целевой продукт, по отношению к общему количеству химически превращенных исходных веществ:
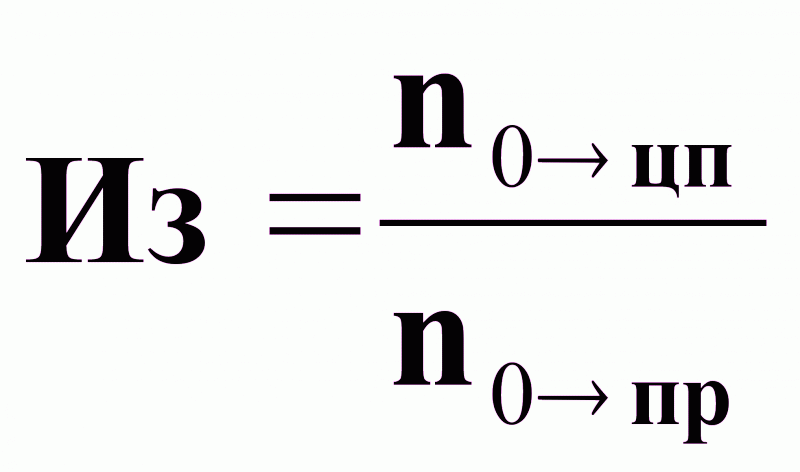 (3).
(3).
где
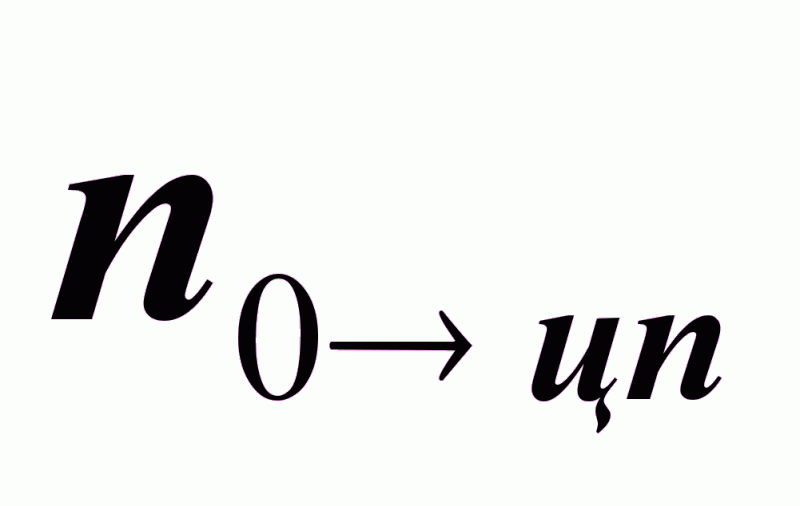 - количество
молей исходного
продукта,
превращенных
в целевой продукт;
- количество
молей исходного
продукта,
превращенных
в целевой продукт;
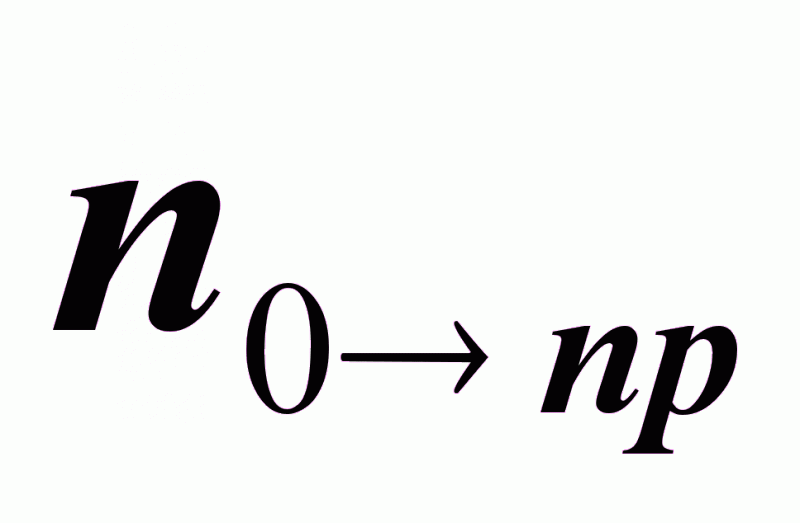 - количество
молей химически
превращенных
исходных веществ.
- количество
молей химически
превращенных
исходных веществ.
Избирательность влияет на экономические показатели процесса.
Скорость химического процесса.
Скорость химического процесса - это количество вещества, которое реагирует или образуется в единицу времени в единице объема (или на единице поверхности):
 (4),
(4),
где
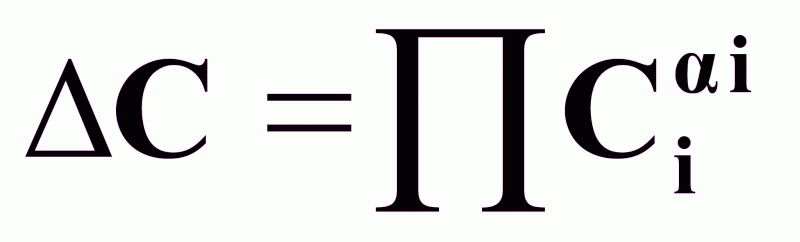 -
движущая
сила процесса,
-
движущая
сила процесса,
определяемая для химических реакций как произведение концентраций компонентов в степенях, равных их стехиометрическим коэффициентам;
К - константа скорости реакции,
определяемая на основании уравнения Аррениуса.
Скорость процесса характеризует производительность химического реактора.
Основные факторы, влияющие на скорость реакции:
С0 - состав исходных реагентов;
θ - температура;
Р - давление.
Схема реактора непрерывного действия с мешалкой
с экзотермической реакцией 1-го порядка А В.
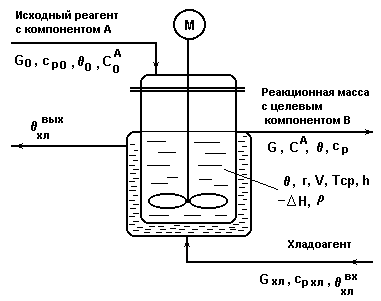
Рис.4.1.
Показатель эффективности реакторного процесса в общем случае - концентрация целевого продукта в реакционной смеси СВ .
Цель управления в общем случае:
обеспечение в реакционной смеси
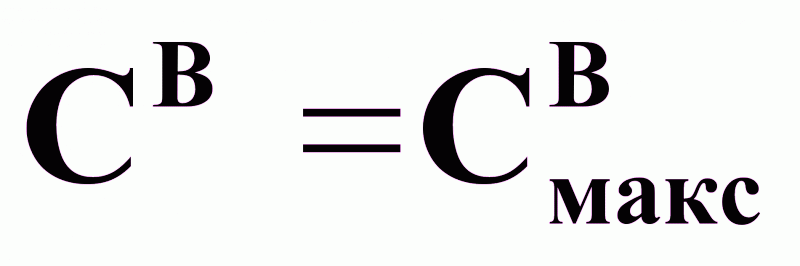 .
.
Цель управления для данного процесса:
обеспечение в реакционной смеси
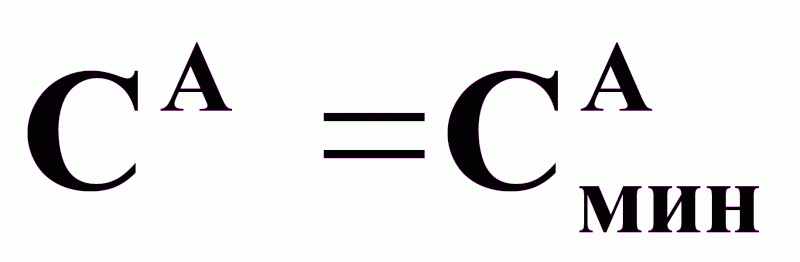 .
.
Обозначения на рис.4.1:
G0 , G , Gхл - массовые расходы исходного реагента, реакционной смеси и хладоагента, кг/с;
cp0 , cp , cpхл - удельные теплоемкости соответствующих потоков, дж/(кг*град);
- плотность реакционной смеси, кг/м3 ;
0 , , хл - температуры исходного реагента, реакционной смеси и хладоагента;
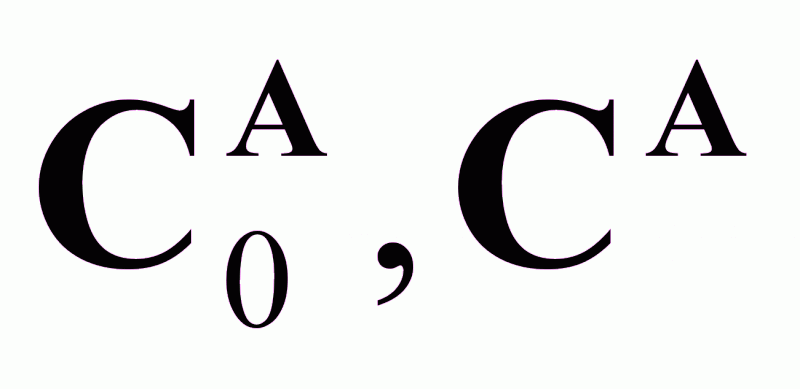 - концентрации
компонента
А в исходном
реагенте и
реакционной
смеси, кг/кг;
- концентрации
компонента
А в исходном
реагенте и
реакционной
смеси, кг/кг;
V - объем реакционной смеси, м3 ;
h - уровень реакционной смеси, м;
Tср - среднее время пребывания реакционной массы в реакторе;
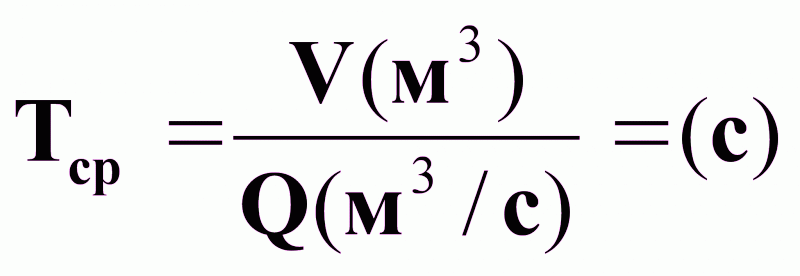
-H - тепловой эффект экзотермической реакции, дж/кг;
r - скорость химической реакции, кг/(м3*с).
Математическое описание реактора
на основе физико-химических особенностей процесса.
Стехиометрическое уравнение химической реакции.
Стехиометрическое уравнение химической реакции, характеризующее ее материальный баланс:
 (1а).
(1а).
Стехиометрическое уравнение для данного реактора:
 (1б),
(1б),
где i , i , , - стехиометрические коэффициенты, числа реагирующих молей компонентов процесса.
Уравнение кинетики химической реакции.
Результирующая скорость обратимой реакции:
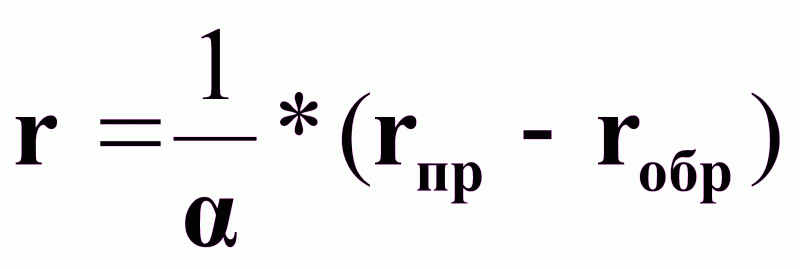 (2),
(2),
где
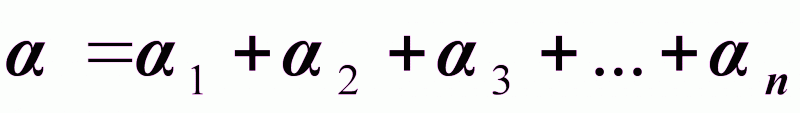 - общий
порядок реакции;
- общий
порядок реакции;
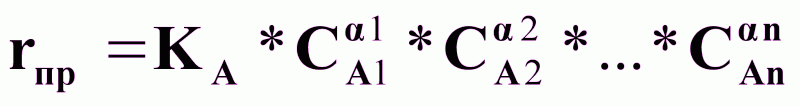 - скорость
прямой реакции;
- скорость
прямой реакции;
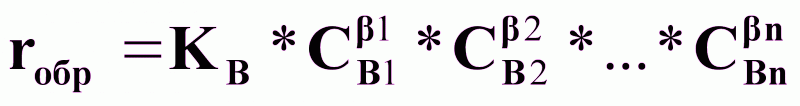 - скорость
обратной реакции;
- скорость
обратной реакции;
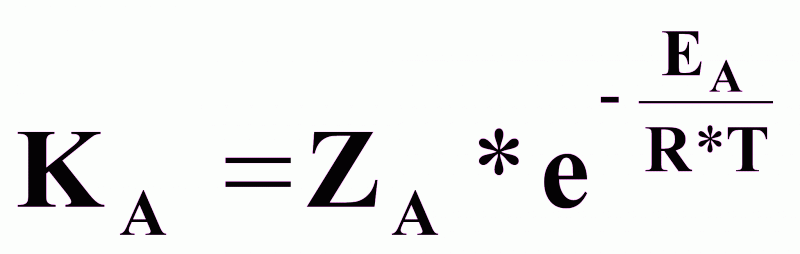 ;
;
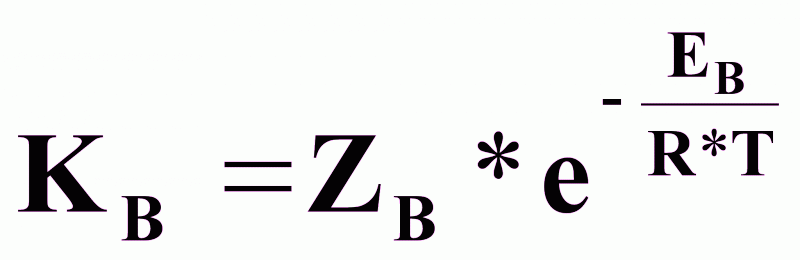 - константы
скорости,
- константы
скорости,
ZА и ZВ - эмпирические коэффициенты;
ЕА и ЕВ - энергии активации.
Кинетика для реактора типа рис.4.1:
скорость прямого процесса:
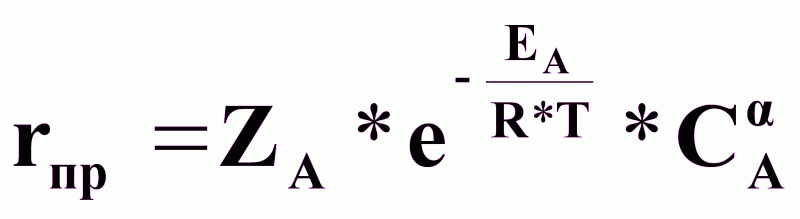
29-04-2015, 04:00
