На основании (17) и (18):
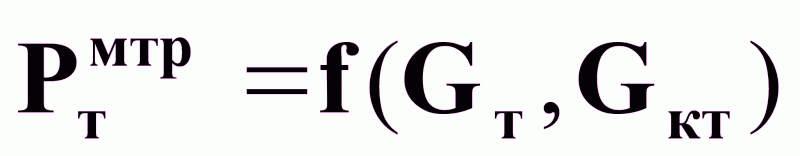 (19).
(19).
Предпочтительное управляющее воздействие Gт.
Информационная схема процесса выпаривания.
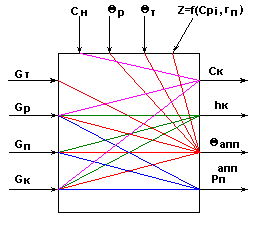
Рис.3
Возможные управляющие воздействия:
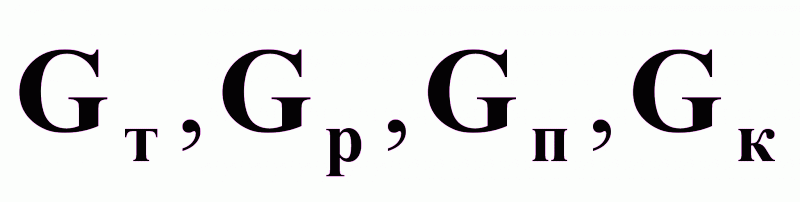 .
.Возможные контролируемые возмущения:
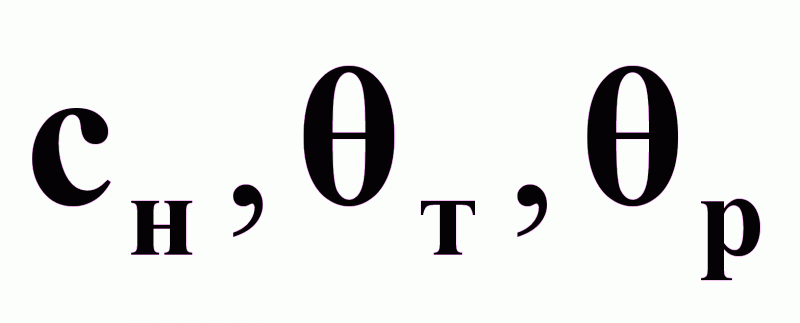 .
.Возможные неконтролируемые возмущения:
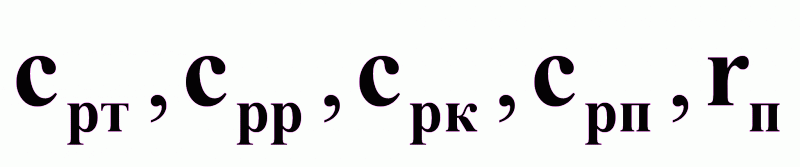 - удельные
теплоемкости
потоков срi
и теплота испарения
растворителя
rп .
- удельные
теплоемкости
потоков срi
и теплота испарения
растворителя
rп .Возможные управляемые переменные:
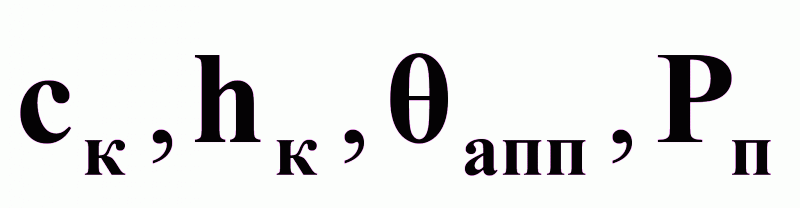 .
.
На основании рис.3 выпарная установка является сложным многосвязным объектом по возможным управляющим воздействиям
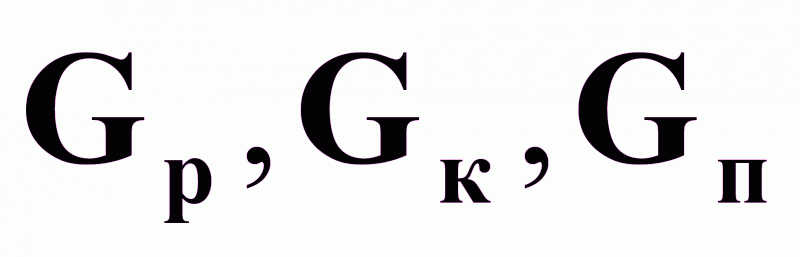 .
.
Типовая схема автоматизации процесса выпаривания.
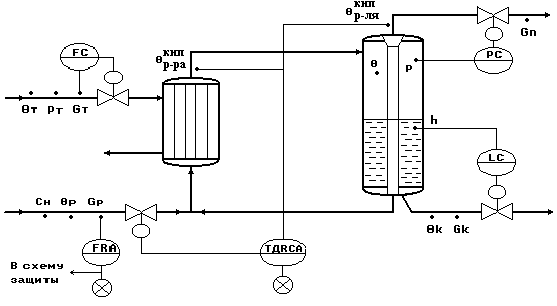
Рис.4.
Типовое решение автоматизации процесса выпаривания.
Регулирование.
Регулирование температурной депрессии Δд по подаче исходного раствора Gр - как параметра, косвенно характеризующего показатель эффективности процесса выпаривания ск .
Регулирование давления в сепараторе Рпапп по отбору паров растворителя Gп - для обеспечения материального баланса по паровой фазе.
Регулирование уровня в сепараторе hк по отбору концентрированного раствора Gк - для обеспечения материального баланса по жидкой фазе.
Стабилизация расхода теплоносителя Gт - для обеспечения теплового баланса установки
Контроль.
расходы - Gт, Gр, Gк, Gп;
температуры -
 ;
;давление - Рп апп, Рт;
уровень концентрированного раствора в аппарате - hк;
Сигнализация.
существенные отклонения
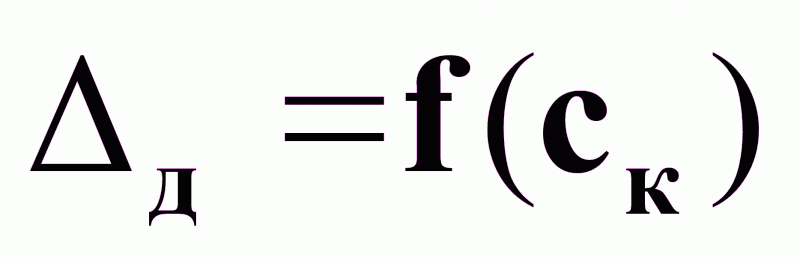 от задания;
от задания;Прекращение подачи исходного раствора Gр , при этом формируется сигнал «В схему защиты».
Система защиты.
По сигналу «В схему защиты» - открывается магистраль Gп, отключается подача теплоносителя и отбор концентрированного раствора.
СОДЕРЖАНИЕ
Материалы к лекции №1 5
Материалы к лекции №2 12
Материалы к лекции №3 21
Материалы к лекции №4 26
Материалы к лекции №5 35
Материалы к лекции №6 44
Материалы к лекции №7 54
Материалы к лекции №8 70
Министерство образования Российской федерации
Санкт-Петербургский государственный технологический институт
(технический университет)
Кафедра автоматизации процессов химической промышленности
Г.В. Иванова
«Автоматизация технологических процессов
основных химических производств»
Методические материалы по курсу лекций
(в двух частях)
Часть 2.
2003г.
УДК 66-52:66(075)
Иванова Г.В. Автоматизация технологических процессов основных химических производств: Методическое пособие. Часть 2 / СПбГТИ(ТУ).-СПб., 2003.- 70с.
Методическое пособие предназначено для курса лекций по учебной дисциплине «Автоматизация технологических процессов основных химических производств», являющейся дисциплиной специализации 210201 – «Автоматизация технологических процессов химической промышленности» учебного плана по специальности 210200.
Пособие разработано в виде методических материалов, используемых при чтении лекций по дисциплине.
Часть 2 методического пособия включает в себя физико-химические основы технологических процессов, технологические схемы рассматриваемых объектов управления, математические описания объектов управления, постановку задачи автоматизации, типовые схемы автоматизации, типовые решения автоматизации для массообменных и реакторных процессов.
Утверждено на заседании методической комиссии факультета Информатики и управления 23 июня 2003г., протокол № 6.
Материалы к лекции №9
Общая характеристика массообменных процессов
Вид диаграммы равновесия
для системы с 3 степенями свободы
c1* =f(c2) при θ=const и P=const;
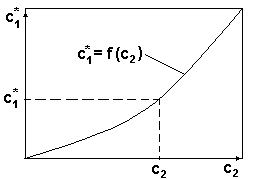
Рис.2.
На диаграмме обозначено:
c1 - концентрация компонента в газовой фазе, cy.
c2 - концентрация компонента в жидкой фазе, cх.
при cх =c2, равновесное значение концентрации в газовой фазе будет cy* = c1*.
Вид диаграммы равновесия
для системы с 2 степенями свободы
c1* =f(c2) при Р=const.
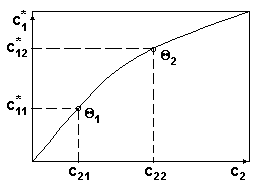
Рис.3.
Каждая точка кривой рис.3 соответствует равновесному состоянию при различных температурах.
Отношение концентраций фаз при равновесии называют коэффициентом распределения:
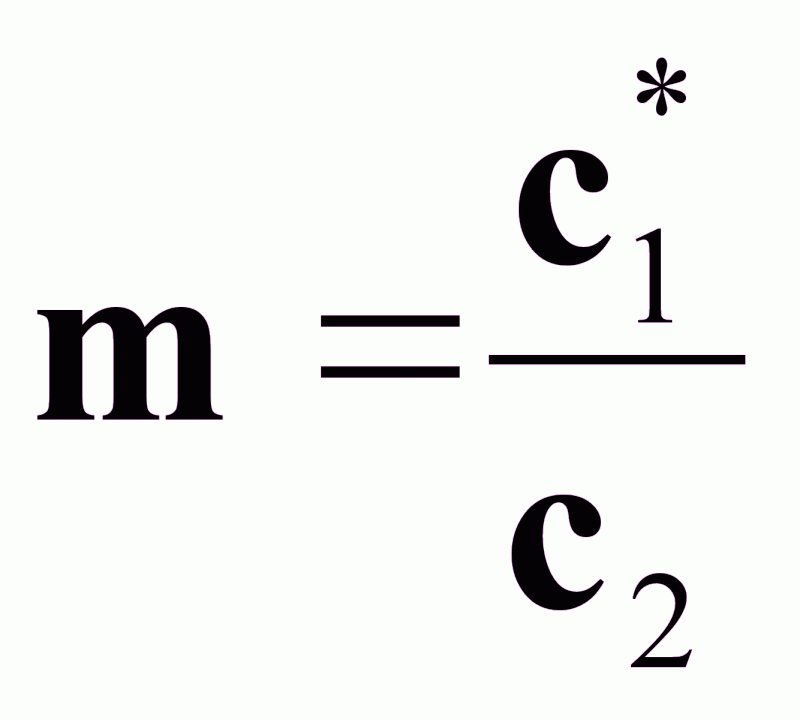 (3).
(3).
Графически m можно определить:
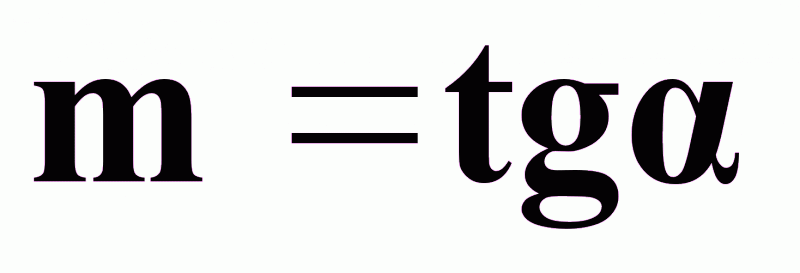 ,
,
т. е.как тангенс угла наклона касательной к линии равновесия, если она нелинейна,
или как тангенс угла наклона самой линии равновесия, если она линейна.
Уравнение рабочей линии процесс массопередачи
при противотоке распределяющих веществ.
Схема движения распределяющихся веществ
противотоком:
 G1
c1
G1
c1
с1н с1к
с2к с2н
G2 c2
Рис.1.
Материальный баланс процесса по целевому компоненту можно записать в виде:
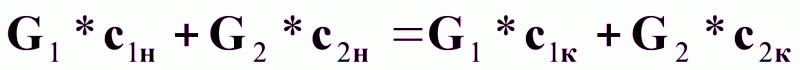 (1),
(1),
или
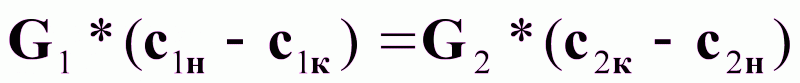 (2).
(2).
Для произвольного сечения аппарата с концентрациями с1 и с2 можно записать:
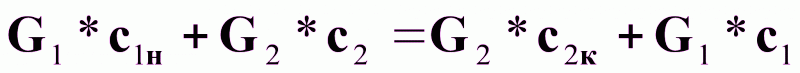 (3а).
(3а).
или
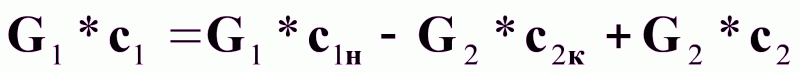 (3б).
(3б).
Выразим из (3б) зависимость с1 = f(с2):
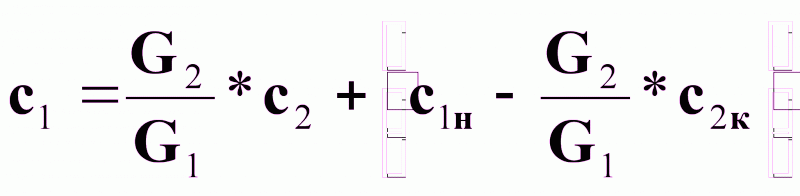 (4).
(4).
Выражение (4) - уравнение рабочей линии (рабочих концентраций) массопередачи.
Это уравнение прямой с
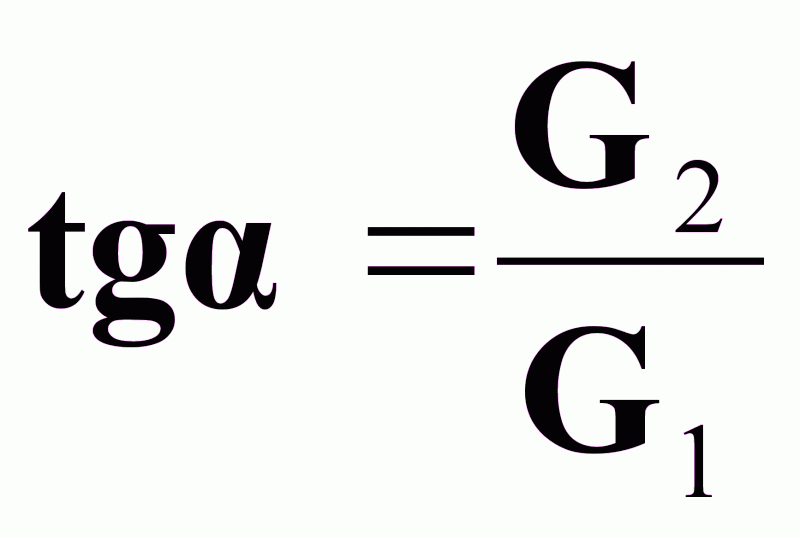 .
.
Рабочая линия всего аппарата ограничена точками с координатами с1н , с1к , с2н , с2н .
Вид рабочей линии
при противотоке распределяющих веществ.
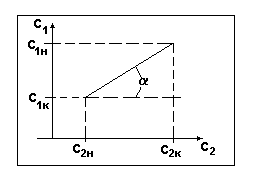
Рис.2.
Уравнение рабочей линии процесса при прямотоке
распределяющих веществ.
Схема движения распределяющихся веществ
прямотоком:
 G1
c1
G1
c1
с1н с1к
с2н с2к
G2 c2
Рис.3.
Материальный баланс процесса по целевому компоненту можно записать в виде:
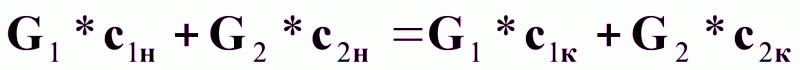 (5),
(5),
или
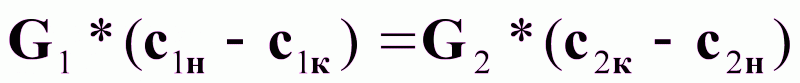 (6).
(6).
Для произвольного сечения аппарата с концентрациями с1 и с2 можно записать:
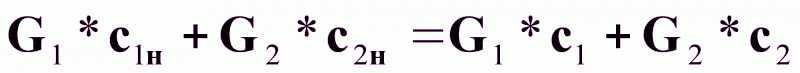 (7а)
(7а)
или
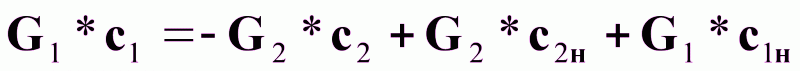 (7б).
(7б).
Выразим из (7б) зависимость с1 = f(с2):
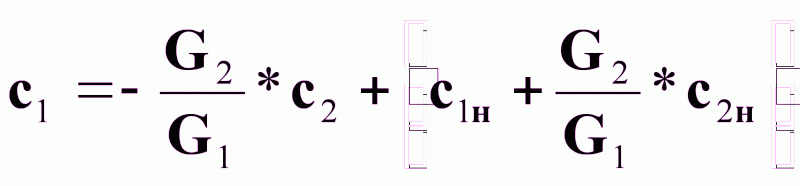 (8).
(8).
Выражение (8) - уравнение рабочей линии (рабочих концентраций массопередачи) при прямотоке распределяющих веществ.
Это уравнение прямой с
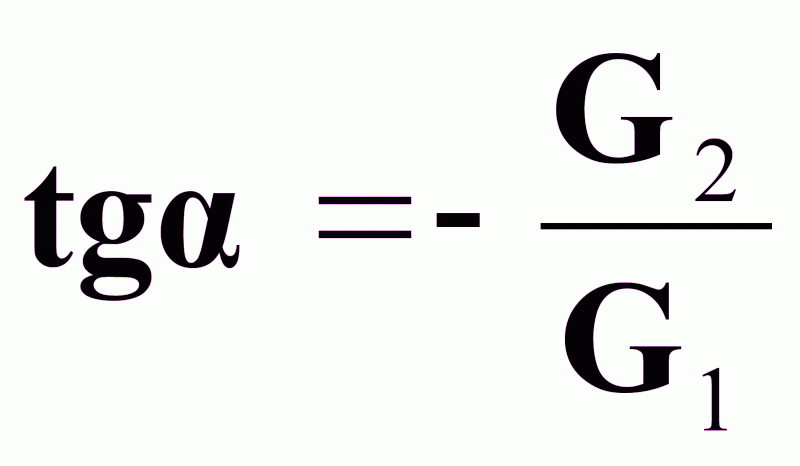 .
.
Рабочая линия всего аппарата ограничена точками с координатами с1н , с1к , с2н , с2н .
Вид рабочей линии
при прямотоке распределяющих веществ.
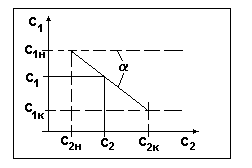
Рис.4.
Диаграмма с1-с2 при расположении рабочей линии
выше равновесной.
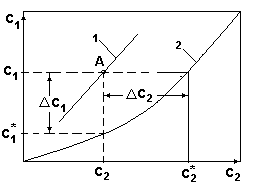
Рис.1.
Из диаграммы рис.1 следует:
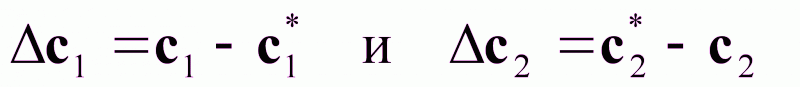
Это означает, что целевой компонент будет переходить из фазы G1 в фазу G2.
Диаграмма с1-с2 при расположении рабочей линии
ниже равновесной.
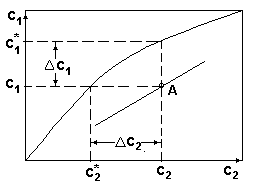
Рис.2
Из диаграммы рис.2. следует:
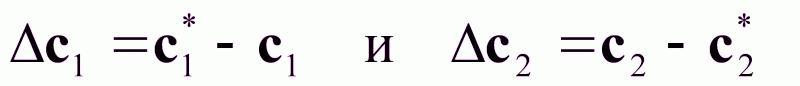
Это означает, что целевой компонент будет переходить из фазы G2 в фазу G1.
Средняя движущая сила процессов массопередачи.
при
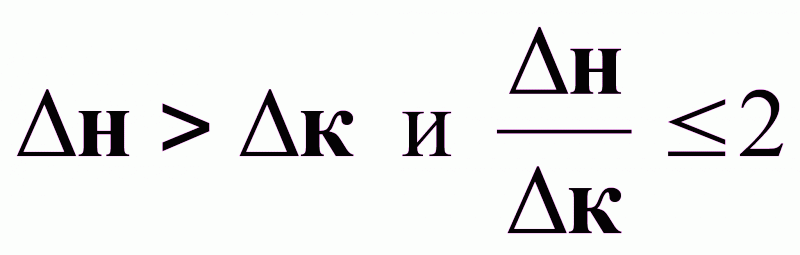 :
:
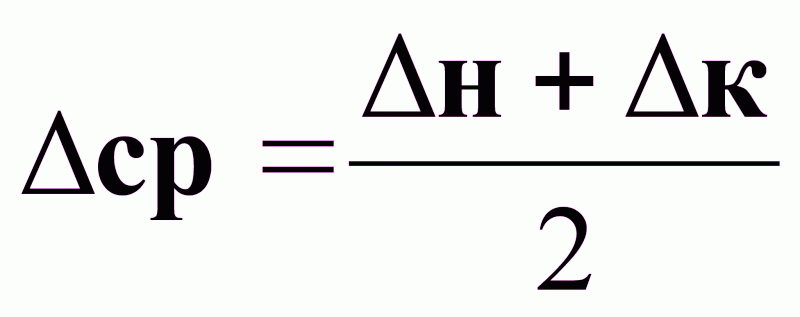 (1).
(1).
при
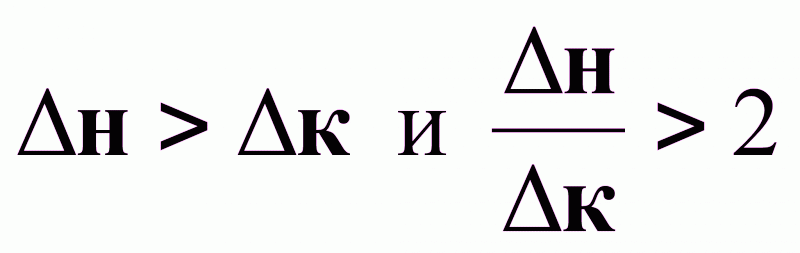 :
:
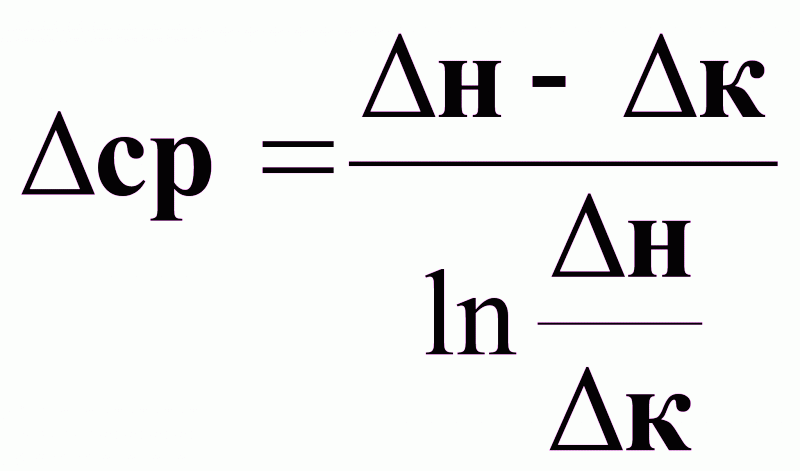 (2).
(2).
Основное уравнение массопередачи.
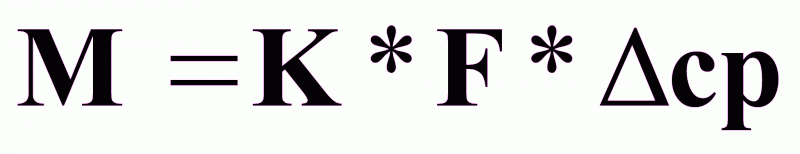 (1),
(1),
где М - масса переносимого вещества, кг/с;
К - коэффициент
массопередачи,
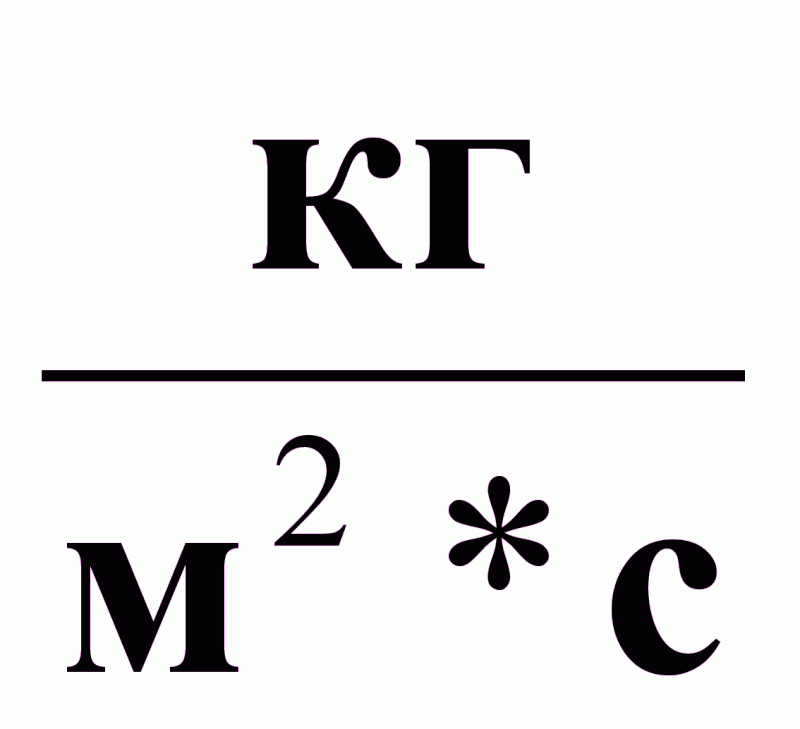
∆ср - средняя движущая сила процесса массопередачи.
Определение движущей силы по каждой из фаз:
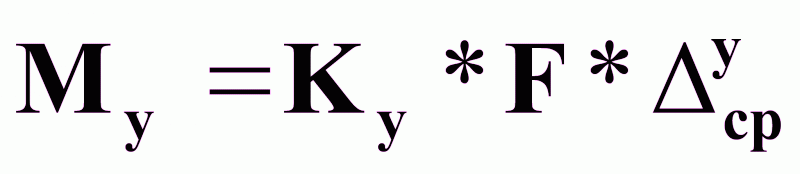 (2),
(2),
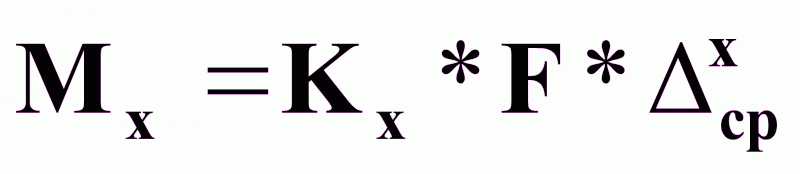 (3),
(3),
где
∆срy и ∆срx - средние движущие силы, в фазах y и x;
Ky и Kx - коэффициенты массопередачи для фаз y и x.
Материалы к лекции №10
Автоматизация процесса кристаллизации
Система с резким возрастанием растворимости.
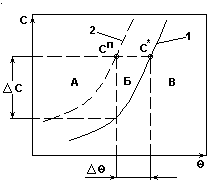
Рис.1.
- c*=f() - кривая растворимости, характеризующая равновесие концентрированного раствора при изменении .
- сп= f() - линия условной границы метастабильной области.
А - неустойчивая, лабильная область массового образования центров кристаллизации;
Б - относительно устойчивая метастабильная область образования и растворения кристаллов;
В - область ненасыщенных растворов.
Система с плавным изменением растворимости.
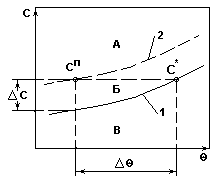
Рис.2.
Переход в область пересыщенных растворов происходит только при значительном охлаждении.
При этом выделяется незначительное количество твердой фазы.
Рекомендуемый способ кристаллизации - получение сп удалением части растворителя из раствора.
Рекомендуемый метод кристаллизации - вакуум-кристаллизация.
Система с незначительным изменением
растворимости.
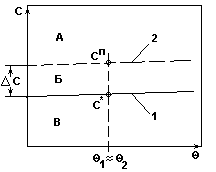
Рис.3.
Рекомендуемый способ кристаллизации - получение сп путем выпаривания растворителя из раствора.
Рекомендуемый метод кристаллизации - изотермическая кристаллизация.
Изотермическая кристаллизация - это кристаллизация с удалением части растворителя испарением или вымораживанием.
Система с незначительным изменением
растворимости.

Рис.3.
Рекомендуемый способ кристаллизации - получение сп путем выпаривания растворителя из раствора.
Рекомендуемый метод кристаллизации - изотермическая кристаллизация.
Изотермическая кристаллизация - это кристаллизация с удалением части растворителя испарением или вымораживанием.
Кинетика процесса кристаллизации.
Скорость образования центров кристаллизации:
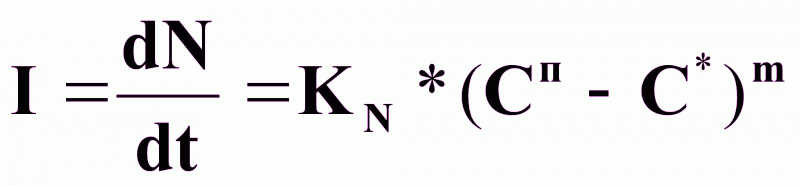 ,
,
где
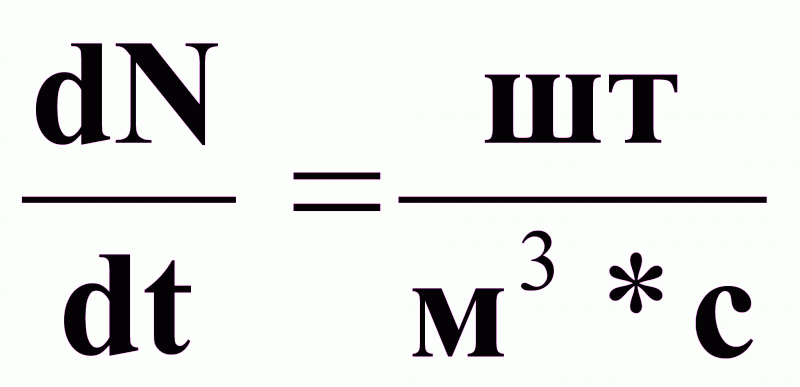 - число
частиц, образующихся
в единице объема
в единицу времени;
- число
частиц, образующихся
в единице объема
в единицу времени;
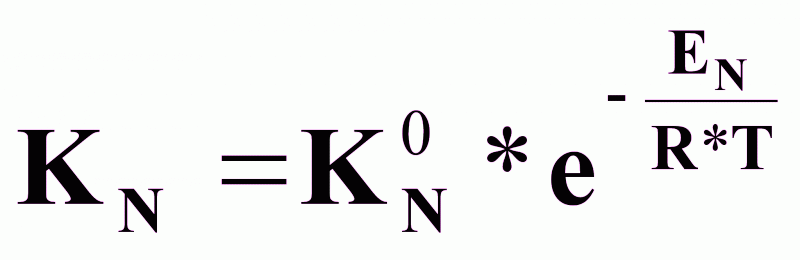
КN,
КN0
- константы,
 ,
,
EN - энергия активации зародышеобразования, (кдж/кг);
Сп и С* - концентрации пересыщенного и насыщенного растворов, (кг/м3);
m=2 - 4 - кинетический коэффициент, зависящий от типа кристаллизующегося вещества.
Качественная характеристика скорости роста кристаллов.
Зависимости скорости кристаллизации от времени.
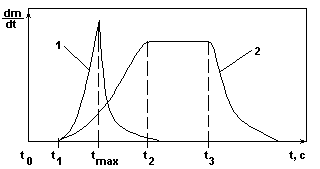
Рис.4.
-
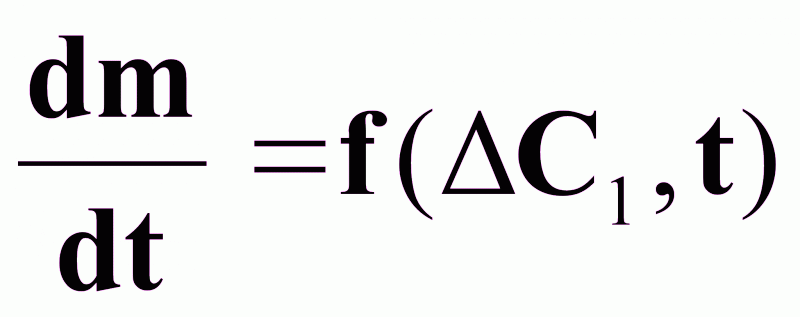 ;
;-
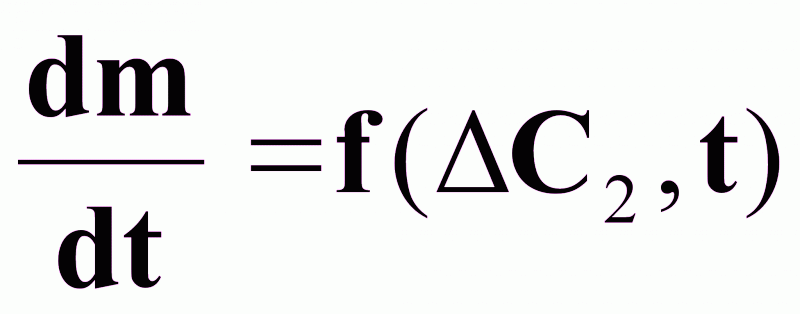 ;
;
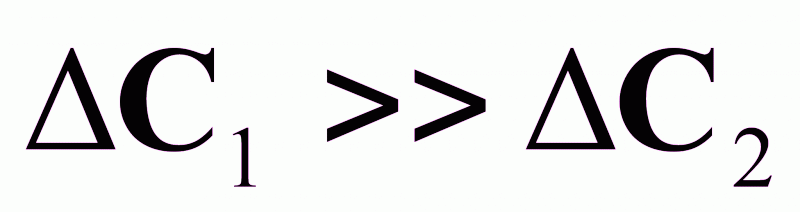 .
.
t0 - t1 - индукционный период, т.е. период подвижного равновесия зародышей с раствором.
Кривая 1 - при большой степени пересыщения имеет резкий максимум скорости процесса в момент tmax.
Кривая 2 - при малой степени пересыщения имеет пологий максимум в течение времени t2 - t3.
Количественные оценки скорости роста кристаллов на основании диффузионной теории.
Процесс встраивания молекул в кристаллы идет с большой скоростью и кинетика процесса определяется скоростью подвода вещества к поверхности кристалла:
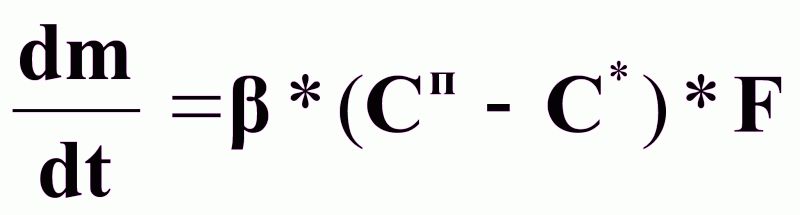 (1),
(1),
где
- коэффициент массоотдачи, кг/м2*с;
Сп-С*=, (кг/кг);
F - поверхность кристалла, (м2).
Для аппаратов с мешалками коэффициент массоотдачи зависит от следующих параметров:
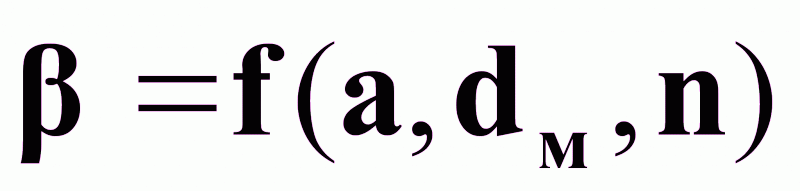 ,
,
где
а - характеристический размер кристалла;
n - число оборотов мешалки, об/мин;
dм - диаметр мешалки, м.
Процесс подвода вещества к поверхности кристалла идет с большой скоростью. Кинетика процесса определяется скоростью встраивания молекул в кристалл:
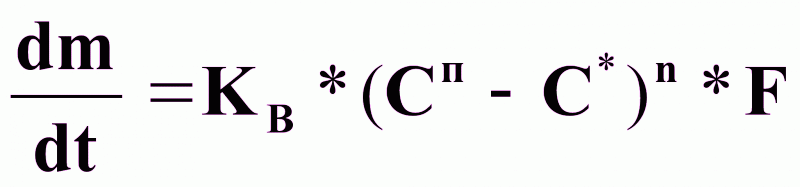
29-04-2015, 04:00
