Пацієнтам та студентам проводили антропометричні вимірювання: ІМТ, ОТ, окружність стегон (ОС), співвідношення ОТ/ОС, сагітальний діаметр живота (СДЖ) (U. Riserus etal., 2004). Відсоток жиру в тілі (ВЖТ) визначали методом біоелектричного імпедансу за допомогою апарата BodyFatMonitorBF306 фірми OMRON(P. Deurenbergetal., 1998). Товщина вісцерального жиру (ТВЖ) вимірювалась ультразвуковим методом (F.F. Ribeiro-Filhoetal., 2003) на апараті AlokaSSD-500 (Японія). Одночасно проводили ультразвукове дослідження печінки та інших органів черевної порожнини й нирок.
Забір венозної крові для лабораторних досліджень проводили зранку натще. У сироватці крові визначали концентрацію глюкози глюкозооксидазним методом та інсулін імунорадіометричним методом набором Insulin(e) IRMAKITфірми Immunotech(Чеська Республіка). Вираховувався індекс ІР HOMA-IRза формулою HOMA-IR= (глюкоза натще, ммоль/л Ч інсулін натще, мкМО/мл / 22,5 (D.R. Matthewsetal., 1985). Проводився оральний глюкозотолерантний тест (ОГТТ) із визначенням рівня глюкози та активності піруватдегідрогенази (ПДГ) натще та на 120-й хвилині тесту. Активність ПДГ визначали фериціанідним методом (Ю.М. Островский, 1979) у нашій модифікації. Концентрацію лактату визначали спектрофотометрично новим ферментативним методом із використанням L-лактат:цитохром с-оксидоредуктази (флавоцитохром b2, КФ 1.1.2.3), виділеної з клітин метилотрофних дріжджів Hansenula polymorpha (О. Smutoketal., 2005; Г.С. Осьмак та співав., 2006; О.В. Смуток та співав., 2006).
Рівень ЗХС визначали ензиматичним пероксидазним методом C.C. Allainetal. (1974), P. Roeschlau(1974), ХС-ЛПВГ – за методикою M.F. Lopes-Virellaetal. (1977) та H. Parraetal. (1982), ТГ – за G. Bucolo, H. David(1973) в модифікації P. Fossati, L. Prencipe(1980). Вираховували концентрацію холестерину ліпопротеїнів низької густини (ХС-ЛПНГ) за формулою W.T. Friedewaldetal. (1972), концентрацію холестерину не ліпопротеїнів високої густини (ХС-не-ЛПВГ), як різницю між ЗХС і ХС-ЛПВГ (A.M. Wagneretal., 2003). Вираховувались співвідношення ЗХС/ХС-ЛПВГ – атерогенний індекс (А.Н. Климов, 1977; W.H. Ettingeretal., 1992), ТГ/ХС-ЛПВГ (A.M. Wagneretal., 2005) і ТГ/ХС-не-ЛПВГ. Визначали рівень сечової кислоти у сироватці крові уриказно-пероксидазним методом (D. Barham, P. Trinder, 1972; P. Fossatietal., 1980). Визначення глюкози, сечової кислоти та ліпідів крові проводили за допомогою стандартних наборів реагентів фірми PointeScientific(США) та біохімічного аналізатора BTS-370 plusфірми Biosystems(Іспанія).
Визначали рівень С-реактивного протеїну (СРП) імуноферментним тестом UBIMAGIWELCRPQuantitativeфірми UnitedBiotechInc. (США) на апараті LabsystemMultiskanEX(Фінляндія). Оцінювали кількість тромбоцитів у периферичній крові та їх агрегаційну здатність з аденозиндифосфатом (АДФ) на основі візуальної оцінки за А.С.Шитиковою (1984). Коагуляційний гемостаз вивчали за концентрацією фібриногену гравіметричним методом за Р.А. Рутберг (1961), розчинних фібрин-мономерних комплексів (РФМК) фенантроліновим РФМК-тестом набором реагентів фірми Технология-Стандарт (Росія) (З.С. Баркаган, А.П. Момот, 2001), D-димерів фібрину імуноферментним методом за допомогою набору фірми TechnocloneGmbH(Австрія) (W. Nieuwenhuizen, 1997), за етаноловим тестом (H.C. Godaletal. 1971), протромбіновим часом та індексом за методом Quick.
Ехокардіографію проводили у В- і М-режимі за допомогою апарата AlokaSSD-500 (Японія).
Визначення 10-річного ризику розвитку важкої ІХС (інфаркту міокарда й коронарної смерті) та 10-річного ризику ішемічного інсульту (першого) проводилось за Фремінгемським профілем ризику (R.B. D'Agostinoetal., 1994; NCEPATPIII, 2001; L.B. Goldsteinetal., 2006).
Діагностику МС проводили на основі рекомендацій Міжнародної федерації з вивчення діабету (K.G. Albertietal., 2005; O.I. Мітченко, 2007). Діагноз НАЖХП базувався на рекомендаціях МОЗ України (Ю.М. Степанов, Ф.Ю. Филиппова, 2004) та A. Lonardoetal. (2006).
Для статистичного опрацювання результатів використовували пакет програм “StatisticaforWindows5.0” (Statsoft, USA). Параметричні та рангові показники порівнювали за допомогою U-критерію Манн-Вітні, оскільки, як засвідчила перевірка з допомогою критерію Шапіро-Вілкса, їх розподіл у вибірках не відповідав закону нормальності. Ці показники описано за медіаною [нижній – верхній квартилі]. Для визначення зв’язку між якісними характеристиками застосовували критерій ч2 Пірсона та точний критерій Фішера. Для з’ясування корелятивних зв’язків визначали критерій фКендалла. Проводили аналіз Вальда та багатофакторний дискримінантний покроковий аналіз.
Результати дослідження та їх обговорення. Проаналізувавши результати обстеження студентів, було виявлено, що в них часто зустрічаються такі чинники ризику розвитку МС, ЦД та ССХ, як надмірна маса тіла та ожиріння 1 ступеня (12%), підвищений ВЖТ (40,2%), знижена фізична активність (59,4%), незбалансована дієта (56,9%), куріння (20,8%) та вживання алкоголю (55%), підвищення АТ ³130/85 мм рт. ст. (31,9%), обтяжений родинний анамнез щодо ожиріння (в 34%), АГ (у 60%), інсульту (в 29%), ІХС (у 27%) та ЦД (у 20%). Частота основної ознаки МС – збільшеної ОТ – складала 11,1%, а поєднання двох компонентів МС (збільшена ОТ та АТ ³130/85 мм рт. ст.) – 6,6%.
У чоловіків суттєво частіше спостерігалися надмірна маса тіла (НМТ) та ожиріння, підвищений ВЖТ, АТ понад 130/85 мм рт. ст., дієтичний дисбаланс, куріння, вживання алкоголю (рис. 1) та обтяжена щодо ССХ спадковість (у 37% порівняно з 19% у жінок, р<0,0001), а в жінок – дефіцит маси тіла (в 15,4% порівняно з 2,1% в чоловіків) і мала фізична активність. Внаслідок гіподинамії відзначалося не тільки відносне (зростання ВЖТ), але й абсолютне зниження маси м’язової тканини, про що свідчив підвищений ВЖТ у худих осіб. Так, у 33,6% студентів з ІМТ <25 кг/мІ відзначено надмірний ВЖТ, як у жінок (35,0%), так і в чоловіків (30,7%).
В осіб молодого віку простежувався прямий кореляційний зв’язок між ІМТ та АТ – систолічним і діастолічним (ф=0,21, р<0,0001 та ф=0,13, р<0,0001, відповідно). Крім того, виявлено вірогідні позитивні кореляції між курінням/кількістю викурюваних на день цигарок та АТ, ІМТ, ОТ, ОС, ОТ/ОС, кількістю випитого алкоголю на тиждень, що відображає часте поєднання чинників ризику та взаємозв’язки між ними. Отже, вже в молодому віці, особливо в чоловіків, визначається підвищений ризик виникнення ССХ та ЦД 2-го типу, що потребує опрацювання та впровадження відповідної програми ранньої профілактики цих хвороб.
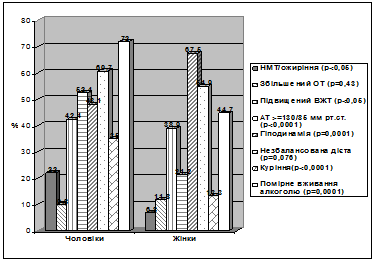
Рис. 1. Частота факторів ризику цукрового діабету та ішемічної хвороби серця в людей молодого віку
У студентів з обтяженою спадковістю щодо ССХ і ЦД набуті чинники ризику виявлялися загалом з такою ж частотою, як і в студентів без спадкових факторів. Однак у студентів із поєднанням спадковості щодо ожиріння і ЦД (n=36) ІМТ понад 25 кг/мІ зустрічався частіше (в 19,4%), ніж у групі без цих чинників – у 6,8% (p=0,024). Отже, в цих випадках слід надавати особливого значення контролю за масою тіла.
Виходячи з отриманих результатів, можна виділити початкову фазу розвитку МС, коли ще немає його ознак, але наявні спадкові та/або набуті чинники ризику розвитку МС: гіподинамія, дієтичний дисбаланс, надмірна маса тіла, підвищення ВЖТ, шкідливі звички, обтяжена спадковість щодо ожиріння, ЦД 2-го типу та ССХ.
Послідовність подальшого розвитку МС нами було досліджено на основі аналізу клініко-лабораторних показників у сформованих групах пацієнтів. Усіх обстежених з абдомінальним ожирінням було розподілено за кількістю критеріїв МС на три групи: 1 група – 28 пацієнтів із однією-двома ознаками МС, 2 група – 68 пацієнтів із трьома-п’ятьма ознаками МС, без ЦД чи ССХ, 3 група – 84 хворих із МС у поєднанні з хворобами, що з ним асоціюються: ЦД 2-го типу і/або ССХ. Групи суттєво не різнились між собою та з контролем за гендерним складом. Порівняно з контрольною групою здорових осіб лише хворі 3 групи були вірогідно старшими. Вік хворих був істотно більший у 2 та 3 групах порівняно з 1 групою та в 3 групі порівняно з 2 групою (p<0,001). Групи не відрізнялися між собою за ІМТ. АГ 1-3 ступеня зустрічалася в 1 групі в 12 пацієнтів (43%), в 2 групі – у 63 (93%) і в 3 групі – у 83 (99%), р<0,001. Враховуючи принцип розподілу пацієнтів на групи та вікові відмінності, такий розподіл, на нашу думку, можна вважати моделлю розвитку МС з прогресуванням метаболічних порушень та виникненням ЦД та ССХ.
Серед критеріїв МС, поряд із збільшенням ОТ, найчастіше виявлявся АТ ³130/85 мм рт. ст. (57,1%, 95,6% і 100% відповідно в 1, 2 і 3 групах, р<0,0001).
Пацієнти 1 групи відзначалися вірогідно вищими показниками ожиріння (крім ТВЖ), ніж у контролі. У 94,4% осіб спостерігався високий і дуже високий ВЖТ. Підвищений рівень глюкози натще виявлено в 3,6% випадків. У пацієнтів були вищими порівняно з контролем рівень інсуліну (6,3 [6,0-6,5] мкМО/мл проти 4,9 [4,8-6,0] мкМО/мл, р<0,01) та HOMA-IR(1,34 [1,31-1,44] од. проти 1,16 [1,00-1,37] од., р<0,05), частота ІР складала 16,7%. За літературними джерелами, порогові значення HOMA-IRдля діагностики ІР відрізняються в різних дослідженнях та базуються на даних обстеження практично здорових осіб (E. Bonoraetal., 1998; A. Lonardo et al., 2006). У нашій роботі для констатації ІР ми обрали значення HOMA-IR, вище від максимального значенні в контрольній групі – ³1,45 од.
Характеризуючи ліпідний обмін у пацієнтів 1 групи, слід відзначити, що в 10,7% з них була зниженою концентрація ХС-ЛПВГ, у 7,1% − підвищений рівень ТГ ≥1,7 ммоль/л, але не виявлено гіпертригліцеридемії (понад 2,3 ммоль/л). У них спостерігалися вищі концентрації ЗХС (5,41 [4,74-5,69] ммоль/л) та холестерину апоВ-вмісних ліпопротеїнів – ХС-ЛПНГ (3,14 [2,88-3,64] ммоль/л), ХС-не-ЛПВГ (3,67 [3,26-4,13] ммоль/л), ніж у контролі (відповідно, 4,75 [4,58-4,99] ммоль/л, р<0,05; 2,72 [2,48-2,88] ммоль/л, р=0,012 та 3,13 [2,91-3,30] ммоль/л, р<0,05); сумарна частота дисліпідемій складала 21,4%. Гіперурикемію виявлено в 17,9% пацієнтів.
У 41,7% хворих 1 групи концентрація СРП перевищувала рівень 3 мг/л, який асоціюється з високим ризиком серцево-судинних ускладнень (P.M. Ridkeretal., 2004). Пацієнти характеризувалися значущо вищими агрегаційною активністю тромбоцитів, рівнями РФМК та етанолового тесту порівняно з контролем. У 15,4% випадків була підвищеною концентрація фібриногену, у 11,5% – РФМК (маркер тромбінемії – гіперкоагуляції), у 20,8% – позитивний етаноловий тест. У 14,3% випадків рівень D-димера перевищував 120 мкг/л, що розцінюється як ознака підвищеного ризику виникнення тромбозу (M. Cushmanetal., 1999; M. Cushmanetal., 2003). У 58,3% пацієнтів 1 групи не було виявлено відхилень у вивчених показниках коагуляційного гемостазу.
У 20% пацієнтів 1 групи спостерігалося концентричне ремоделювання лівого шлуночка (ЛШ), у 10% − його гіпертрофія (рис. 2), у 10% – дилатація ЛП, у 5% – дилатація ЛШ. Середню та високу категорію 10-річного ризику (³10%) важкої ІХС встановлено в 14,3% пацієнтів 1 групи (рис. 3).
Таким чином, у пацієнтів 1 групи виявлено підвищений серцево-судинний ризик, про що можна судити, виходячи з структурних змін серця, рівня в крові прозапальних та протромботичних маркерів, а також 10-річного ризику ІХС. Про зростання ризику діабету свідчать вищі рівні інсуліну та HOMA-IR, ніж у контролі. Отже, наявність у пацієнтів з 1-2 ознаками МС предикторів ЦД 2-го типу та ССХ обґрунтовує потребу виділити цю фазу формування МС.
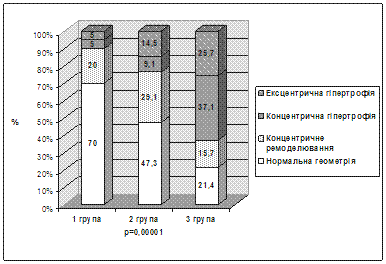
Рис. 2. Геометрія лівого шлуночка в пацієнтів з метаболічним синдромом
Аналізуючи клініко-лабораторні дані в пацієнтів з МС 2 групи, встановлено, що 95,3% з них мали підвищений ВЖТ. Виявлено більш виражений абдомінальний тип ожиріння за вірогідно вищим співвідношенням ОТ/ОС, ніж у 1 групі. Рівні глюкози та інсуліну натще істотно не відрізнялися від даних у 1 групі, але значущо більшим було значення HOMAIR– 2,26 [1,41-3,44] од. (р<0,05) і концентрація глюкози на 120-й хвилині ОГТТ (5,45 [4,85-6,30]ммоль/л проти 4,40 [4,30-6,00]ммоль/л, р<0,05). Підвищену концентрацію глюкози натще виявлено в 33,8%, ІР – у 72,2% випадків.
У 2 групі порівняно з 1 групою вірогідно вищою була концентрація ТГ та нижчим рівень ХС-ЛПВГ. Хоча рівень ЗХС суттєво не відрізнявся, в них істотно вищим виявився рівень ХС-не-ЛПВГ – 4,3 [3,6-5,2] ммоль/л проти 3,7 [3,3-4,1] ммоль/л (р<0,05), що відображає зростання холестерину апоВ-вмісних ліпопротеїнів. У пацієнтів з МС найчастішим порушенням ліпідного обміну був підвищений рівень ТГ ≥1,7 ммоль/л – у 75% випадків (у 51,5% виявлено гіпертригліцеридемію). Інша ознака дисліпідемії при МС – зниження рівня ХС-ЛПВГ – зустрічалася в 44,1% пацієнтів. Частота гіперхолестеринемії складала 26,5%. Сумарна частота дисліпідемій у цих хворих – 75%. Гіперурикемію виявлено в 33,8% пацієнтів.
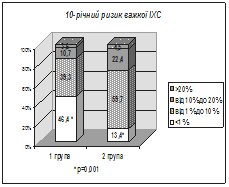
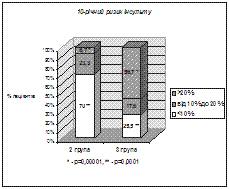
Рис. 3. Частота категорій 10-річного ризику важкої ІХС та ішемічного інсульту в групах пацієнтів з метаболічним синдромом
Щодо маркерів системного запалення та гіперкоагуляції, то, хоч пацієнти 2 групи істотно не різнилися за їх концентраціями від 1 групи, але вони мали вірогідно частіше підвищений рівень фібриногену – в 38,4% випадків. Рівень СРБ >3 мг/л зустрічався в 54,6% хворих. У 21,2% випадків виявлялася гіперкоагуляція (за підвищеним рівнем РФМК), у 27,7% був позитивним етаноловий тест. Рівень D-димера не перевищував 120 мкг/л. Показники коагуляційного гемостазу були в межах норми в 43,1% хворих.
У 52,7% пацієнтів 2 групи виявлено порушену геометрію ЛШ у вигляді концентричного ремоделювання (29,1%) та гіпертрофії (23,6%) (рис. 2). Високий і дуже високий 10-річний ризик (³10%) важкої ІХС визначено в 26,9% хворих, ішемічного інсульту – в 30,0% обстежених (рис. 3). 10-річний ризик ІХС суттєво вищий порівняно з 1 групою.
У 3 групі підвищений ВЖТ зустрічався в 85,7% пацієнтів. У них виявлено вірогідно вищі показники ОТ/ОС та ТВЖ порівняно з 1 групою. Частота такої ознаки МС, як підвищена глюкоза натще і/або ЦД 2-го типу складала 48,8%. Істотно вищими (p<0,05) виявилися значення HOMA-IR(2,27 [1,45-3,36] од.) та концентрація глюкози натще (5,4 [4,9-7,2] ммоль/л), ніж у 1 групі (рівень глюкози 5,0 [4,9-5,4] ммоль/л), а також вищий рівень глюкози на 120-й хвилині ОГТТ (8,1 [6,3-8,8] ммоль/л) порівняно з 1 і 2 групами. Частота ІР досягала в них 76,5%. Хворі 3 групи відзначалися значущо нижчою активністю ПДГ (7,9 [2,7-8,1] мккат/л), ніж у 1 групі (16,2 [10,81-20] мккат/л, р<0,05) та 2 групі (12,2 [8,11-13,51] мккат/л, р<0,05).
За більшістю показників ліпідного обміну хворі 3 групи не відрізнялися від пацієнтів 2 групи, частота підвищеного рівня ТГ становила 69%, а зниженого ХС-ЛПВГ – 40,5%. Але співвідношення ТГ/ХС-не-ЛПВГ виявилося значущо нижчим порівняно з таким у 2 групі (відповідно, 0,46 [0,31-0,66] та 0,55 [0,40-0,79], р<0,05). Використовуючи послідовний аналіз Вальда, було знайдено, що показник ТГ/ХС-не-ЛПВГ <0,40 є характерним для хворих з ІХС та ЦД та свідчить, очевидно, про підвищення концентрації апоВ-вмісних ліпопротеїнів. Частота гіпертригліцеридемії та високого рівня ЗХС складала в 3 групі, відповідно, 45,2% і 34,5%, що істотно вище, ніж у 1 групі. Гіперурикемію виявлено в 35,7% пацієнтів.
Пацієнти 3 групи характеризувалися вірогідно вищою концентрацією СРП та частотою рівня СРП >3 мг/л (90,6%), вищими рівнями РФМК та етанолового тесту, порівняно з 1 та 2 групами. Значення фібриногену, РФМК та етанолового тесту залишалися в межах норми лише в 31,7% осіб (p=0,03 порівняно з 1 групою). Позитивний етаноловий тест зустрічався в 46,3% випадків – значущо частіше, ніж у 1 та 2 групах. Підвищений рівень РФМК знайдено в 35,4% хворих, така ж частота і гіперфібриногенемії. Концентрація D-димераперевищувала 120 мкг/л у 37,5% хворих, що значущо різниться з даними в 2 групі(p=0,02), де такі значення не виявлялися.
У 79% хворих 3 групи виявлено зміни в геометрії ЛШ. Це була переважно гіпертрофія (в 62,8%) (рис. 2) та діастолічна дисфункція (в 85%). 10-річний ризик ішемічного інсульту в 3 групі був вищим порівняно з 2 групою. Високий або дуже високий ризик виявлено в 74,3% хворих, що значущо більше, ніж у 2 групі (30%, p=0,0001) (рис. 3).
Отже, хворі з МС та ССХ/ЦД відрізняються від пацієнтів з МС, у яких не діагностовано цих хвороб, тим, що в них, поряд з більш вираженими вісцеральним ожирінням та порушеннями вуглеводного обміну, значно вищим виявляється атеротромботичний серцево-судинний ризик.
Пацієнтів 3 групи було поділено на підгрупи залежно від нозологічних форм. Порівнюючи дві підгрупи – хворих на ІХС (n=44) та на ЦД (n=19), встановлено, що рівень глюкози натще в пацієнтів з ЦД був вищим, а концентрація інсуліну – нижчою. Тому індекс HOMA-IRсуттєво не відрізнявся. У хворих на ЦД істотно частіше виявлявся підвищений рівень ТГ (89,5% порівняно з 54,5%, р=0,01). У них спостерігалися значущо вищі рівні маркерів системного запалення: СРП (24,7 [18,8-25,6]мг/л проти 6,3 [4,0-11,5]мг/л) і фібриногену (4,3 [4,0-5,0]г/л проти 3,5 [3,3-4,0]г/л). Вищою була й частота гіперфібриногенемії (53% порівняно з 25%, р<0,05). Пацієнти з ІХС характеризувалися вірогідно більш вираженими структурно-функціональними змінами ЛШ.
В обстежених пацієнтів із ЦД та з ІХС виявлено більш виражену активацію системного запалення за рівнем СРП порівняно з пацієнтами 2 групи – з МС без ЦД/ІХС (3,3 [1,6-6,7] мг/л, р<0,05), а також фібриногену (4,0 [3,3-4,5] г/л, р<0,05 порівняно з хворими на ЦД), а в хворих на ІХС – вищі концентрації D-димера (68 [58-213] мкг/л порівняно з 38 [30-70] мкг/л у 2 групі, р<0,05), що свідчить про активацію коагуляційного гемостазу.
Із викладених результатів випливає, що МС за відсутності ССХ та ЦД характеризується низкою суттєвих порушень у вуглеводному, ліпідному обміні, активацією системного запалення та коагуляційного гемостазу, розвитком структурно-функціональних порушень серця, отже, є станом підвищеного ризику ЦД 2-го типу та ССХ. За наявності наслідків (ускладнень) МС, таких як ЦД 2-го типу та ІХС, стан організму суттєво різниться від такого при неускладненому МС. Передусім це стосується більш вираженої активації запалення (особливо в
8-09-2015, 23:55
