Отримані результати обґрунтовують доцільність конкретизації критеріїв МС шляхом вилучення з ознак неускладненого МС наявність ЦД і чітко окресливши його як стан предіабету та високого ризику ССХ. Поєднання МС з ЦД і/або ІХС слід вважати наступною, пізньою фазою розвитку МС після його прогресування від наявності 1-2 ознак до синдрому з 3-5 компонентами.
Таким чином, формування та перебіг МС доцільно розглядати як динамічний процес, з певними закономірностями розладів метаболізму та високим ризиком розвитку ССХ та ЦД 2-го типу. Тому для оптимізації діагностики, профілактики і лікування пацієнтів з МС було запропоновано класифікацію МС за фазами його перебігу (табл. 1).
Таблиця 1
Класифікація метаболічного синдрому за фазами перебігу
| Фаза | Клінічні прояви |
| 0. Початкова | Наявні спадкові та/або набуті чинники ризику МС |
| 1. Формування | Наявні одна або дві ознаки МС: абдомінальне ожиріння або його поєднання з одним з інших чотирьох критеріїв, без діагностованих ЦД та ССХ. |
| 2. Розгорнута | МС з трьома-п’ятьма ознаками, але без ЦД та ССХ. |
| 3. Пізня | МС у поєднанні з ЦД 2-го типу та/або ССХ |
Для конкретизування патогенезу та опрацювання критеріїв діагностики МС було вивчено взаємозв’язки між його ознаками. Встановлено, що абдомінальне ожиріння є найвагомішою клінічною ознакою МС. Показники, що характеризують ожиріння, корелювали з ІР за HOMA-IR(рис. 4). Відповідно, майже з усіма показниками ожиріння (крім ВЖТ) була пов’язана й концентрація глюкози натще. Найбільш значущо корелювала ТВЖ з HOMA-IR. Це відповідає даним B.H. Goodpasteretal. (2005), за якими маса вісцеральної жирової тканини найбільше співвідноситься з ознаками МС. Встановлено, що ОТ та СДЖ тісніше корелюють з ІР, ніж ОТ/ОС (лише тенденція). Рівень ВЖТ також з великою ймовірністю позитивно корелював з HOMA-IR, відображаючи зв’язок ІР з усією масою жирової тканини в організмі та з відносним зниженням маси периферичних м’язів. Таким чином, доповнювати критерії МС можуть такі показними як СДЖ, ТВЖ та рівень ВЖТ.
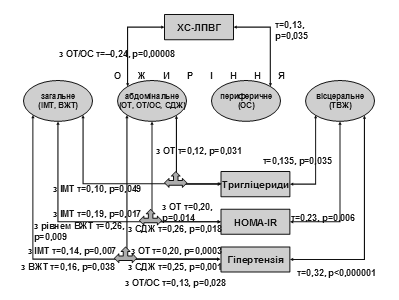
Рис. 4. Зв’язки ожиріння з HOMA-IR, ліпідами крові та гіпертензією
Показники ОТ та ТВЖ істотно прямо корелювали з концентрацією ТГ. Це є підтвердженням того, що збільшене депо вісцерального жиру є джерелом підвищеного рівня ТГ при МС (D. Nievesetal., 2003). Виявлено обернену кореляцію рівня ХС-ЛПВГ з ОТ/ОС та пряму – з ОС, що свідчить про зв'язок між двома протективними щодо атеросклерозу факторами – ХС-ЛПВГ і периферичним жиром. З усіма параметрами ожиріння асоціювалася АГ, найбільш істотно – з ТВЖ (ф=0,32, p<0,000001) та ОТ (ф=0,20, p=0,0003).
Таким чином, ожиріння, особливо абдомінальне й вісцеральне, пов’язане з усіма ознаками МС: з ІР, гіпертензією, дисліпідемією. Показники ОТ, ОТ/ОС та ТВЖ корелюють з числом компонентів синдрому (відповідно, ф=0,18, p=0,001; ф=0,24, p<0,0001 та ф=0,26, p<0,0001). Отримані результати підтверджують домінуючу роль ожиріння у патогенезі МС.
Для того, щоб конкретизувати клініко-лабораторні ознаки ІР, ми порівняли метаболічні та структурно-функціональні показники в пацієнтів, у яких не констатовано ІР (n=23), та в осіб з ІР (n=53). Підтверджено, що найбільш значущо асоціюються з ІР показники абдомінального і вісцерального ожиріння. За дапомогою аналізу Вальда нами знайдено їх значення, що відповідають інсулінорезистентному стану: СДЖ >26 см, ТВЖ ³40 мм та дуже високий рівень ВЖТ. Багатофакторний аналіз показав, що перші два показники є незалежними предикторами ІР.
Пов’язане з ІР також зниження активності ПДГ – 12,5 [10,0-17,5]мккат/л порівняно з 20,0 [13,5-17,5]мккат/л в осіб без ІР (р=0,046). З найбільшими значеннями HOMA-IR(у межах верхнього 4-го квартилю) асоціюються найвищі концентрації лактату (5,6 [4,8-7,0] ммоль/л, р<0,0001 порівняно із рівнями в межах 1-го, 2-го та 3-го квартилів HOMA-IR, відповідно 3,0 [2,7-10,1] ммоль/л, 5,0 [2,8-8,3] ммоль/л та 3,5 [2,3-5,3] ммоль/л). Індекс HOMA-IRзначущо обернено корелював з активністю ПДГ (ф=-0,16, p=0,044). Це підтверджує зв'язок між резистентністю до інсуліну та зниженням активності ПДГ, що призводить до нагромадження пірувату й, відповідно, лактату (J. Lovejoyetal., 1992; M. Curtoetal., 1997). Виявлення зниженої активності ПДГ може використовуватися як маркер інсулінорезистентного стану.
Стосовно асоціацій характерної для МС дисліпідемії з іншими компонентами МС, то в літературі вказується на ІР як на причину підвищеного рівня ТГ та зниженого – ХС-ЛПВГ (M. Adielsetal., 2005; K.G. Parhofer, P.H. Barrett, 2006). Результати нашого дослідження підтверджують лише взаємозв’язок між HOMA-IRта рівнем ТГ, хоча і не на рівні прямої кореляції. Так, у хворих з ТГ ≥1,7 ммоль/л 58% осіб мали індекс HOMA-IRу межах третього-четвертого квартилів, а серед пацієнтів з рівнем ТГ <1,7 ммоль/л – лише 26% (p=0,014). Рівень ТГ прямо корелював з концентрацією глюкози натще (ф=0,10, p=0,047) та, особливо, на 120-й хвилині ОГТТ (ф=0,49, p=0,002). На основі багатофакторного аналізу виявлено, що підвищений рівень ТГ є незалежним предиктором ІР. Отримані дані свідчать про те, що ІР є провідним, хоча й не єдиним механізмом зростання концентрації ТГ.
Виявлено прямий зв'язок між концентрацією ТГ та рівнем сечової кислоти в крові (ф=0,17, p=0,002). Рівень останньої прямо пов'язаний з абдомінальним ожирінням за показником СДЖ (ф=0,16, p=0,041). Підвищений рівень сечової кислоти вважається характерним для МС та асоціюється з ІР, ожирінням, АГ і дисліпідемією (H.J. Milionis et al., 2004; Y. Iwashima et al., 2006; S.D. Lin et al. 2006). В обстежених пацієнтів з МС спостерігався вищий рівень сечової кислоти порівняно з контролем, у 32% з них виявлено гіперурикемію. Однак концентрація сечової кислоти не корелювала з показниками ІР. Результати нашого дослідження свідчать, що гіперурикемія в пацієнтів з МС прямо не пов’язана з ІР, а опосередкована абдомінальним ожирінням та гіпертригліцеридемією.
Щодо рівня ХС-ЛПВГ, то кореляційної залежності його з ІР і рівнем ТГ не виявлено, хоч у літературі вказується на те, що основною причиною зниження ХС-ЛПВГ у пацієнтів з МС є гіпертригліцеридемія (K.G. Parhofer, P.H. Barrett, 2006). Лише в 58% наших хворих із зниженим рівнем ХС-ЛПВГ констатовано підвищення ТГ, і тільки в 37% випадків підвищеного рівня ТГ траплялося зниження ХС-ЛПВГ. Таким чином, у механізмах зниженої концентрації ХС-ЛПВГ при МС можуть мати значення й інші чинники – метаболічні та генетичні (R.C. Ellisonetal., 2004; F.B. Lepiraetal. 2005).
Проведений аналіз виявив U-подібний зв’язок між показниками ІР (концентрація інсуліну, HOMA-IR) та рівнем ЗХС (рис. 5), підтверджену результатами багатофакторного аналізу.
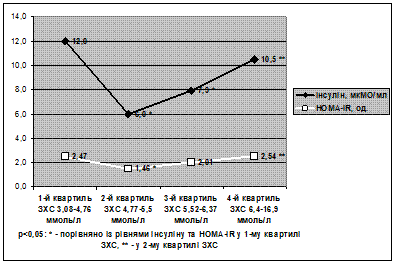
Рис. 5. Зв’язок між інсулінорезистентністю та концентрацією загального холестерину
Описано, що ІР сприяє розвитку АГ (E. Bonoraetal., 1998; S. Bornsteinetal., 2005; V. Lamounier-Zepteretal., 2005). Це підтверджено виявленим значущим кореляційним зв’язком між ступенем АГ та HOMA-IR(ф=0,19, p=0,014). Багатофакторний аналіз показав, що АГ є незалежним предиктором ІР. Ступінь АГ корелює з усіма ознаками МС: показниками, що відображають ожиріння (крім ОС), концентрацією глюкози натще (ф=0,10, p=0,047) та на 120-й хвилині ОГТТ (ф=0,33, p=0,045), рівнем ТГ (ф=0,12, p=0,014), співвідношенням ТГ/ХС-ЛПВГ (ф=0,14, p=0,005); з рівнем ХС-ЛПВГ виявлено тенденцію до оберненого зв’язку (ф=-0,09, p=0,078).
Отже, виявлено взаємозв’язки між усіма компонентами МС, більшість з яких (крім рівня ХС-ЛПВГ) асоціюються з ІР.
Нами простежено кореляційні зв’язки показників, що характеризують прозапальний та протромботичний стан, з компонентами МС. Встановлено, що ожиріння асоціюється із запаленням, гіперкоагуляцією та зростанням агрегаційної активності тромбоцитів, про що свідчать виявлені залежності між ІМТ та рівнем СРП, між ВЖТ та концентрацією фібриногену, між ВЖТ та СРП (рис. 6). Із рівнем ВЖТ пов’язаний час агрегації тромбоцитів, а з СДЖ – рівень D-димера. Таким чином, системний запальний процес та зростання агрегаціїної здатності тромбоцитів асоціюються із загальним ожирінням, що, очевидно, спричинене продукцією цитокінів надмірною масою жирової тканини. Запальні тригери, в свою чергу, призводять до активації тромбоцитів (G. Davietal.,2002). Гіперкоагуляція, про яку свідчить зростання концентрації D-димера, за нашими даними, пов’язана з абдомінальним ожирінням. Ступінь АГ також істотно корелює з показниками запалення й гемостазу, а саме: з рівнями СРП, фібриногену й D-димера.
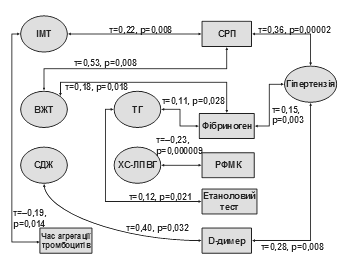
Рис. 6. Зв’язок прозапальних і протромботичних маркерів з ожирінням, гіпертензією та ліпідами крові
Не виявлено вірогідних кореляційних зв’язків індексу HOMA-IRз показниками системного запалення та активацією тромбоцитарного й коагуляційного гемостазу. Але в групі пацієнтів з ІР концентрація фібриногену є значущо вищою – 4,25 [3,63-5,00] г/л порівняно з показником в осіб з нормальною чутливістю до інсуліну – 3,75 [3,25-5,00] г/л (p=0,032), що вказує на взаємозв’язок між ІР та системним запаленням. Концентрація глюкози не корелює з більшістю показників гемостазу й маркерами запалення (лише з етаноловим тестом). Рівень ТГ позитивно корелює з концентрацією фібриногену та етаноловим тестом. Рівень РФМК обернено зв’язаний з концентрацією ХС-ЛПВГ.
Отже, ІР та гіпертригліцеридемія асоціюються з системним запальним процесом низького ступеня активності, а зниження рівня ХС-ЛПВГ – з гіперкоагуляцією. Відомо, що ліпопротеїни високої густини (ЛПВГ) здатні посилювати антикоагулянтну дію протеїну С і зменшувати генерацію тромбіну (J.H. Griffin etal., 2001). Тому зниження рівня ХС-ЛПВГ і асоціюється з підвищенням РФМК – маркером тромбінемії. Таким чином, протромботичний стан, характерний для МС, пов'язаний, зокрема, з порушенням обміну ЛПВГ.
Прогресування МС супроводжується наростанням активації зсідальної системи крові та запалення, про що свідчить прямий зв'язок між кількістю критеріїв МС та рівнем РФМК (ф=0,14, p=0,006), етанолового тесту (ф=0,19, p=0,0002) і ШОЕ (ф=0,18, p=0,002).
Таким чином, із прозапальними та протромботичними маркерами пов’язані ожиріння, гіпертензія, дисліпідемія, наявність ІХС та ЦД 2-го типу.
Показники запалення та гемостазу корелюють із структурно-функціональними змінами серця (рис. 7) та функціональним класом (ФК) ХСН. K. Yamamotoetal. (1995), J. Wangetal. (2003) також знаходять активацію коагуляційного гемостазу в пацієнтів з дилатацією ЛШ та лівого передсердя (ЛП) і вважають, що локальні зміни гемодинаміки та структури розширених камер серця стимулюють генерацію тромбіну.
Вивчаючи кореляційні зв’язки між ехокардіографічними показниками та ознаками МС, встановлено, що з наростанням характерного для МС абдомінального/вісцерального ожиріння (за збільшенням ОТ, ОТ/ОС, СДЖ і ТВЖ) потовщуються стінки ЛШ та розвивається його гіпертрофія, показником якої є індекс маси ЛШ (ІМЛШ) (рис. 7). Ожиріння також асоціюється з розширенням порожнин серця та зниженням скоротливості ЛШ, з ФК ХСН.
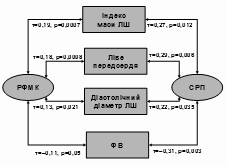
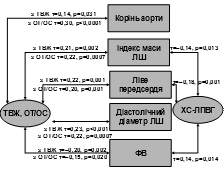
Рис. 7. Зв’язок структурно-функціональних показників серця з протромботичними та прозапальними маркерами, ожирінням і дисліпідемією
Показники ІР – рівень інсуліну та HOMA-IRпозитивно корелюють з ознаками гіпертрофії ЛШ – масою ЛШ (відповідно, ф=0,20, p=0,016 та ф=0,19, p=0,022) та ІМЛШ (ф=0,22, p=0,041 та ф=0,15, p=0,063), що можна пояснити прямою дією на кардіоміоцити інсуліну як фактору росту або опосередковано – через стимуляцію симпатичної нервової системи (G. Grassi, 2006), посилення реабсорбції натрію нирками (A.P. Rocchinietal., 1989) тощо.
Рівень ТГ не виявляє істотного зв’язку з ехокардіографічними даними. Але чітко простежуються обернені кореляції концентрації ХС-ЛПВГ з ІМЛШ (ф=-0,14, p=0,013) та діаметром ЛП (ф=-0,18, p=0,001), який, як відомо, збільшується при діастолічний дисфункції гіпертрофованого ЛШ. Систолічна функція ЛШ також погіршується із зниженням ХС-ЛПВГ (ф=0,14, p=0,014 між фракцією викиду та ХС-ЛПВГ). У літературі вказується на зв’язок гіпертрофії ЛШ та діастолічної дисфункції з рівнем ХС-ЛПВГ (G. Schillacietal., 2001; T. Horioetal., 2003; F. Ananetal., 2007). Пояснюють таку залежність тим, що ХС-ЛПВГ має превентивний вплив на розвиток гіпертрофії серця та діастолічної дисфункції через інгібіцію оксидації ХС-ЛПНГ та активацію синтезу оксиду азоту ендотелієм (J.-R. Nofer, 2004).
Таким чином, розвиток гіпертрофії ЛШ та дилатації ЛП, а також дилатації ЛШ зі зниженням систолічної функції у пацієнтів з МС пов'язаний з АГ, ожирінням, ІР та зниженням ХС-ЛПВГ. Структурно-функціональна перебудова серця асоціюється при цьому з активацією системного запалення та коагуляційного гемостазу. Незалежними предикторами гіпертрофії ЛШ за даними багатофакторного аналізу нами визначено ІР (за HOMA-IR), знижений рівень ХС-ЛПВГ та підвищену концентрацію РФМК.
У пацієнтів з МС маркери запалення і зсідання крові вірогідно позитивно корелюють між собою: рівень фібриногену та етанолового тесту, фібриногену та СРП, РФМК і етанолового тесту, СРП та D-димера. Це підтверджує зв’язок між запаленням і гіперкоагуляцією (M.-C. Tataruetal., 1999).
В обстежених пацієнтів визначено 10-річний ризик гострих серцево-судинних ускладнень – важкої ІХС та ішемічного інсульту, а також вивчено зв’язки рівнів ризику з компонентами МС. Встановлено, що 10-річний ризик як ІХС, так і ішемічного інсульту тісно асоціюється, передусім, з активацією коагуляційного гемостазу та запалення, в основному з концентраціями СРП та РФМК (відсоток 10-річного ризику ішемічного інсульту корелює також з рівнем фібриногену) (рис. 8). Серед показників антропометрії з 10-річним ризиком як ІХС, так і інсульту позитивно пов’язувались ОТ, співвідношення ОТ/ОС та ТВЖ. Причому з найбільшою ймовірністю корелює з цим ризиком показник ОТ/ОС. Слід відзначити, що ризик гострих серцево-судинних ускладнень, за нашими даними, не пов’язаний з загальним ожирінням (за ІМТ та ВЖТ). Значуще позитивно корелює 10-річний ризик ІХС з ІР (за HOMA-IR) та концентрацією ТГ.
Десятирічний ризик ішемічного інсульту обернено корелює з «атерогенним індексом» ЗХС/ХС-ЛПВГ. Хоча ризик інсульту істотно не пов’язаний з рівнями ЗХС та ХС-ЛПВГ, але їх співвідношення, яке відображає поєднання зниження ЗХС та зростання ХС-ЛПВГ, може служити маркером ризику ішемічного інсульту. В літературі знайдено дані про пряму асоціацію між підвищенням рівня ХС-ЛПВГ та ризиком інсульту, однак лише в жінок (M.L. Botsetal., 2002). P. Verdecchiaetal. (2004) дослідили, що ХС-ЛПВГ, як і ХС-ЛПНГ, є незалежним предиктором ризику серцевих, але не цереброваскулярних ускладнень.
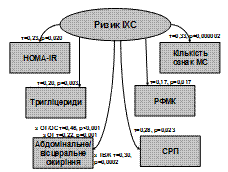
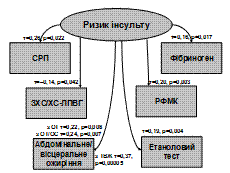
Рис. 8. Кореляційні зв’язки між 10-річним ризиком ішемічної хвороби серця й ішемічного інсульту та антропометричними й метаболічними показниками
Отже, ризик гострих серцево-судинних ускладнень асоціюється з абдомінальним/вісцеральним ожирінням та активацією системного запалення й гемостазу. Ризик важкої ІХС пов’язаний також з ІР та гіпертригліцеридемією, а ризик ішемічного інсульту – із зменшенням співвідношення ЗХС/ХС-ЛПВГ.
Вивчивши стан метаболізму в обстежених пацієнтів з діагностованою НАЖХП, встановлено, що частота окремих компонентів МС та ЦД у них більша порівняно з пацієнтами без НАЖХП (рис. 9).
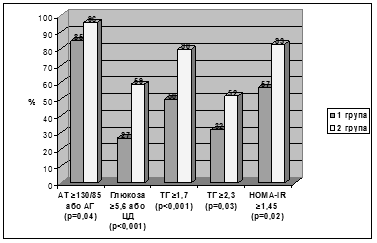
Рис. 9. Частота ознак метаболічного синдрому в групах пацієнтів, у яких не діагностовано (1 група, n=54) та діагностовано неалкогольну жирову хворобу печінки (2 група, n=74)
У пацієнтів з НАЖХП частота виявлення ІР досягала 89%, спостерігався значущо більший ступінь ожиріння, переважно абдомінального/вісцерального, вищі концентрації глюкози, ТГ, нижчі рівні ХС-ЛПВГ та більша кількість ознак МС. Багатофакторний аналіз показав, що наявність НАЖХП є незалежним предиктором ІР.
Результати проведених досліджень дозволили доповнити предиктори ЦД (ознаки ІР) та серцево-судинного ризику в пацієнтів з МС (H.P. Kohler, 2002) критеріями, доступними (за винятком рівня інсуліну та HOMA-IR) для клінічної практики (табл. 2, 3).
Таблиця 2
Предиктори інсулінорезистентності при метаболічному синдромі*
| Підвищені рівні глюкози натще, інсуліну та індекс HOMA-IR |
| Збільшення ІМТ, ОТ, ОТ/ОС, СДЖ (>26 см **), ТВЖ (³40 мм**) та ВЖТ |
| Знижена активність ПДГ, висока концентрація лактату |
| Підвищений рівень ТГ**, висока та знижена концентрація ЗХС** |
| АТ понад 130/85 мм рт. ст. та АГ** |
| Наявність НАЖХП** |
| Підвищений рівень фібриногену |
| Ознаки, пов’язані з ЦД 2-го типу: підвищені рівні глюкози, СРП, фібриногену, поєднання 4-5 критеріїв МС |
| Примітка. *– за даними моно- та багатофакторного аналізу,**– незалежні предиктори. |
Таблиця 3
Предиктори серцево-судинних хвороб при метаболічному синдромі*
| Серцево-судинна патологія | Предиктори |
| ІХС | нижче співвідношення ТГ/ХС-не-ЛПВГ (<0,40), підвищені рівні СРП та D-димера |
| АГ | ожиріння, вищі рівні глюкози, HOMA-IR, ТГ, ТГ/ХС-ЛПВГ, СРП, фібриногену та D-димера |
| Гіпертрофія / дилатація / зниження фракції викиду ЛШ | наявність ІХС, ожиріння, підвищені рівні інсуліну та HOMA-IR**, нижчий рівень ХС-ЛПВГ**, підвищення співвідношення ТГ/ХС-ЛПВГ, вищі концентрації СРП та РФМК** |
| ХСН | ожиріння, вищі рівні СРП, РФМК, D-димера, етанолового тесту |
| Гострі серцево-судинні ускладнення | ожиріння (ОТ, ОТ/ОС, ТВЖ), підвищення рівнів ТГ, СРП, фібриногену, РФМК, гіпертрофія, дилатація та зниження фракції викиду ЛШ, збільшення HOMA-IR^, кількості компонентів МС^, зниження ЗХС/ХС-ЛПВГ# |
Примітка. * – за даними моно- та багатофакторного аналізу, **– незалежні предиктори; ^ – зв'язок лише з 10-річним ризиком важкої ІХС, # – зв'язок лише з 10-річним ризиком ішемічного інсульту. |
|
Слід відзначити, що предиктори ССХ та ЦД 2-го типу пов’язують між собою спільні чинники: ожиріння, АГ, ІР та підвищений рівень ТГ, наявність ЦД 2-го типу. Це вказує на спільні механізми розвитку діабету та ССХ (M. Stern, 1995).
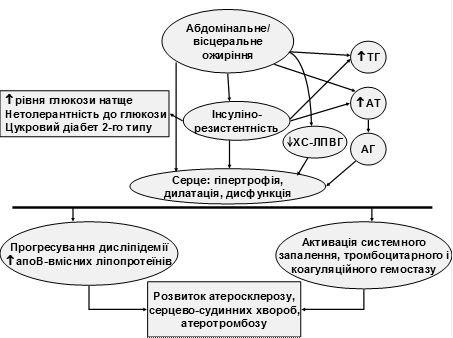
Таким чином, виявлені асоціації відображають основні патогенетичні ланки МС, а встановлені закономірності дозволяють деталізувати механізми розвитку МС (рис. 10). В основі розвитку МС лежить абдомінальне й вісцерального ожиріння, яке супроводжується розвитком ІР. Знижена чутливість до інсуліну, у свою чергу, призводить до підвищення рівня глюкози натще, нетолерантності до неї та ЦД 2-го типу. ІР, поєднуючись із впливом ожиріння й інших чинників, сприяє розвитку гіпертензії та зростанню концентрації ТГ. Зниження рівня ХС-ЛПВГ асоціюється з відносним зменшенням маси периферичного жиру щодо абдомінального. Із персистенцією та прогресуванням ожиріння, ІР, дисліпідемії та гіпертензії розвиваються зміни з боку серця (гіпертрофія, дилатація, дисфункція). Розлади метаболізму та регуляції кровообігу призводять до включення інших ланок патогенезу МС, які спричиняють поглиблення дисліпідемії та підвищене продукування інгібіторів фібринолізу, прокоагулянтів, прозапальних субстанцій. Знижений рівень ХС-ЛПВГ сприяє гіперкоагуляції. Протромботичні порушення наростають із прогресуванням структурно-функціональних змін з боку серця. Дисліпідемія та дисфункція гемостазу призводить до розвитку атеросклерозу, виникнення ССХ та атеротромбозу.
8-09-2015, 23:55
