Структура та обсяг дисертації. Дисертація викладена на 360 сторінках і складається зі вступу, огляду літератури, клінічної характеристики обстежених хворих та опису методик дослідження, 7 розділів результатів власних досліджень, аналізу та узагальнення результатів, висновків, практичних рекомендацій. Перелік джерел літератури містить 648 найменувань, з яких кирилицею – 237, латиницею – 411 (64 сторінки). Робота ілюстрована 19 рисунками та 59 таблицями.
ОСНОВНИЙ ЗМІСТ
Клінічна характеристика хворих та методи дослідження. Для вивчення предикторів виникнення ІМ, його клінічного перебігу, поширеності ускладнень залежно від статі та віку протягом 2001-2007 рр.обстежено 356 пацієнтів (168 жінок і 188 чоловіків) з діагнозом гострий ІМ і ЦД 2 типу та 122 особи (88 чоловіків та 34 жінки) з ІМ без ЦД 2 типу.
Для створення диференційованих програм прогнозування перебігу ІМ та виділення предикторів ризику виникнення ускладнень на стаціонарному етапі лікування хворих на ІМ із супутнім ЦД 2 проведено аналіз бази даних у виборці з 223 пацієнтів віком від 43 до 86 років (середній вік 61,3±0,70 років), з яких 132 чоловіків (59,2%) (середній вік 58,8±0,91 років) та 91 жінок (40,1%) (середній вік 64,2±0,94 років).
З метою вивчення частоти виявлення ЦД 2 типу, статевих і вікових особливостей, госпітальної летальності та причин смерті у хворих на ІМ проведено дослідження, що включало ретроспективний статистичний аналіз даних 1593 карт стаціонарних хворих та 181 протоколів розтинів осіб, які із січня 2001 р. до листопада 2003 р. перебували на лікуванні в інфарктному відділенні клінічної комунальної лікарні швидкої медичної допомоги м. Львова.
До контрольної групи увійшли 25 практично здорових осіб (20 чоловіків та
5 жінок) віком 42-65 років (середній вік 56,2±1,1 років). У дослідження не включались пацієнти на гострий ІМ із супутнім ЦД 1 типу.
Діагноз Q-ІМ встановлювали на основі клінічних, електрокардіографічних і біохімічних критеріїв у відповідності до вимог Європейського Товариства кардіологів (2003) щодо визначення і лікування гострого ІМ із підйомом сегмента ST; діагноз не Q-IM – відповідно до вимог Керівництва Європейського Товариства кардіологів (2002), діагноз ЦД 2 типу – на основі анамнестичних даних та у випадках неодноразового виявлення рівня глюкози в плазмі крові натще 7,0 ммоль/л і вище (ВООЗ, 1999).
Програма дослідження включала збір паспортних, антропометричних даних, з’ясування факторів ризику, особливостей розвитку та клінічного перебігу захворювання, проведення лабораторних та інструментальних обстежень, вивчення стану ліпідного, вуглеводного, жирового, пуринового обміну, системного імунного запалення, метаболізму оксиду азоту, ПОЛ та антиоксидантного захисту, ЕКГ, ЕхоКГ. Забір венозної крові проводився у пацієнтів натще в 1-у та 21-у доби ІМ та через 3 місяці. Дослідження здійснювали на біохімічному аналізаторі ФП-901 (Фінляндія), спектрофотометрі СФ-46 та апараті для електрофорезу ЭПАУ-20-50.
Оцінку станувуглеводного обміну здійснювали шляхом визначення рівня глюкози у капілярній крові за допомогою глюкозооксидантного методу натще й декілька разів впродовж доби (глікемічний профіль), а також рівня глюкози у плазмі крові. У хворих визначали вміст у крові НbА1С за Gabbay K.H. et al. (1979, реактиви фірми Lachema) та іонообмінної спектрофотометрії за методикою набору реактивів фірми «DAC-SpectroMed S.R.L» (Moldova). У підгострий період ІМ серед хворих із проміжним рівнем НbА1С (6,8-8,0%) проводили тест із 75 г глюкози. За його результатами констатували ПТГ при рівні глюкози у плазмі ≥7,8 ммоль/л і <11,1 ммоль/л через 2 години після навантаження, достовірний ЦД 2 типу – при її концентрації понад 11,1 ммоль/л (ВООЗ,1999). Рівень С-пептиду (нг/мл) визначали за допомогою набору реактивів фірми «DRG Instruments GmbH» (Німеччина).
Для встановлення інсулінорезистентності (ІР) визначали рівень імунореактивного інсуліну в сироватці крові натще з використанням реактивів фірми «DRG Instruments GmbH» (Німеччина) та обчислювали загальноприйняті індекси, що характеризують ІР: а) індекс HOMA (інсулін сироватки натще (мклОД/мл)×глюкоза крові натще (ммоль/л)/22,5; б) індекс QUICKI (1/log інсуліну (мклОД/мл)+log глюкози (мг/дл); в) індекс McAuley(EXP (2,63–0,28×LN (інсуліну натще [мклОд/мл]))–0,31×LN (тригліцериди[ммоль/л]); г) індекс Caro (глюкоза (ммоль/л )/інсулін (мклОд/мл));д) індекс Bennetta 1/LN (глюкоза (ммоль/л)×інсулін (мклОд/мл).
Стан ліпідного обміну досліджували шляхом визначення рівнів загального холестерину (ЗХС) за C.C. Allain et al. (1974, в модифікації Labsystems, Finland), холестерину ліпопротеїдів високої густини (ХС ЛПВГ) – в б-ліпопротеїдах, тригліцеридів (ТГ) – методом Fletcher (1968, в модифікації Lachema), холестерину ліпопротеїдів низької густини (ХС ЛПНГ) та дуже низької густини (ХС ЛПДНГ), коефіцієнту атерогенності (КА), ХС не-(ЛПВГ) – шляхом розрахунку: рівень ХС ЛПНГ – за формулою Фрідвальда (ХС ЛПНГ=ЗХС–(ХС ЛПВГ+ТГ/2,2) (ммоль/л)), КА – за формулою Клімова (КА=(ЗХС–ХС ЛПВГ)/(ХС ЛПВГ)), ХС не-(ЛПВГ)=ЗХС–ХС ЛПВГ (ммоль/л). Вміст аполіпопротеїнів А1 (апо-А) та В (апо-В) визначали імунотурбідиметричним методом (Orion Diagnostica (Фінляндія)).
Стан пуринового обміну оцінювали шляхом визначення вмісту у крові сечової кислоти за Marimont (1965) у модифікації А.М. Горячковского (1998). При вивченні жирового обміну в сироватці крові методом ELISA твердофазного імуноферментного аналізу визначали рівень лептину «DRG Instruments GmbH» (Німеччина).
Перекисне окислення ліпідів досліджували шляхом визначення рівня в крові малонового діальдегіду (МДА) за методом Е.Н. Коробейнікової (1989), дієнових кон’югат плазми (ДКп) та еритроцитів (ДКе) – методом І.Д. Стальної зі змінами за В.П. Верболовичем (1989). Стан системи антиоксидантного захисту – шляхом визначення вмісту церулоплазміну (ЦП) методом Ревина в модифікації С.В. Бестужева і В.Г. Колб (1982), глутатіону відновленого (ГВ) в еритроцитах крові – методом Э. Батлер, О. Дюбон, Б. Келли, антиоксидантної активності плазми (АОАп) та еритроцитів (АОАе) – тіобарбітуровим методом на спектрофотометрі СФ-46.
Активність системного запалення оцінювали методом ELISA – твердофазного імуноферментного аналізу, яким визначали вміст у крові інтерлейкіну–4 (ІЛ-4) та фактору некрозу пухлин-б (ФНП-б) за допомогою моноклональних антитіл реактивів фірми «Diaclone» (Франція); С-реактивний білок (СРБ) «Diagnostic Automation Inc» (США) та загальний фібриноген (ЗФ) – методом Р.А. Рутберга (1961). Оцінку метаболізму оксиду азоту (NO) здійснювали шляхом визначення рівня в крові загального оксиду азоту (Total NO) з допомогою реактивів фірми «R&D Systems Inc» (США).
Для встановлення розладів функції печінки у хворих на ІМ та супутній ЦД 2 типу визначали активність g-глютамілтранспептидази (g-ГТП) (В.Г. Колб, В.С. Камышников, 1982).
В обстежених осіб вимірювали ріст, масу тіла, об’єм живота та стегон. Розраховували індекс маси тіла (ІМТ) за формулою: маса тіла/ріст2 (кг/м2 ) та індекс абдомінального ожиріння (ІАО) (см) шляхом визначення відношення об’єму живота на рівні пупка до об’єму стегон на рівні великих вертлюгів стегнових кісток.
Ехокардіографічне дослідження проводили на ультразвуковому діагностичному апараті SIEMENS SONOLINE SL-1. Визначали кінцево-діастолічний та систолічний розмір (КДР, КСР) лівого шлуночка (ЛШ), товщину міжшлуночкової перегородки і задньої стінки ЛШ, розмір лівого передсердя і правого шлуночка, розраховували кінцево-діастолічний та кінцево-систолічний об'єми (КДО, КСО) ЛШ. Фракцію викиду обчислювали за методом Simрson.
Таблиця 1
Перелік проведених спеціальних методів дослідження хворих
на ІМ з і без ЦД 2 типу
| Дослідження | Кон-троль | Хворі на ІМ і ЦД | Хворі на ІМ без ЦД |
Ліпідний спектр крові : а) ЗХС, ХС ЛПНГ, ХС ЛПВГ, ТГ, ХС ЛПДНГ; б) апо-А, апо-В |
25 11 |
173 78 |
90 70 |
Вуглеводний обмін: а) НbА1С б) Інсулін, С-пептид |
25 11 |
171 84 |
122 27 |
| Пуриновий обмін (сечова кислота) | 15 | 104 | 50 |
Показники ПОЛ а) МДА б) ЦП |
15 |
120 74 |
90 70 |
| Показники запалення та метаболізму оксиду азоту (Total NO, ФНП-б, ІЛ-4) | 11 | 63 | 50 |
| Визначення СРБ | 11 | 90 | 48 |
| Жировий обмін (лептин) | 12 | 64 | 15 |
| Визначення г-ГТП | 25 | 171 | 90 |
| Ехокардіографія | 25 | 196 | 90 |
Отримані результати обробляли за допомогою статистичних пакетів «Excel» і «STATISTICA 5.5». Параметричні дані подано у вигляді M±m (середніх значень показників та їх похибок) після перевірки на нормальність розподілу за допомогою критерію Колмогорова-Смірнова. Для оцінки міжгрупових відмінностей застосовували непарний t-критерій Стьюдента для неперервних величин і непараметричний критерій Манна-Уітні для рангових характеристик. При визначенні зв’язків між показниками використовували лінійний кореляційний аналіз із визначенням коефіцієнту кореляції Пірсона (r), при порівнянні таблиць частот – точний критерій Фішера для таблиць 2х2 і х2 для більших. Достовірними вважали відмінності при р<0,05. У ході прогнозування ускладнень ІМ (досягнення кінцевої точки) було проведено послідовний аналіз Вальда з виведенням кількісної характеристики у балах. Для тих ознак, які мали значущий зв’язок із досягненням комбінованої кінцевої точки принаймні в одній із груп порівняння, визначали міру інформативності Кульбака та виведенням відносного ризику (Relative risk, RR) події з 95% довірчим інтервалом. Для виявлення незалежних предикторів досягнення кінцевої точки і створення прогностичної моделі було проведено багатофакторний покроковий дискримінантний аналіз.
Результати дослідження.
У результаті ретроспективного аналізу даних 1593 карт стаціонарних хворих на гострий ІМ (611 (38,4%) жінок та 982 (61,6%) чоловіки) за трирічний період встановлено, що частка осіб із ЦД 2 типу становить 15,1%. При цьому у жінок із гострим ІМ супутній ЦД 2 типу виявляється майже у двічі частіше, ніж у чоловіків (відповідно у 20,1% і 12,1%). Істотне зростання частоти виникнення ІМ на фоні ЦД 2 типу зафіксовано у пацієнтів віком 45-60 років, незалежно від статі, найчастіше – серед осіб старших 50 років. У цьому віці ІМ і супутній ЦД 2 типу виявлено у 44 (26,2%) жінок, що у 1,3 рази більше ніж серед пацієнтів без ЦД (19,8%) (p>0,05), а у чоловіків – у 87 (46,2%) і 316 (36,5%) відповідно (р>0,05). Питома вага чоловіків віком 45-60 років з ІМ і ЦД 2 типу майже у 2 рази більша, ніж жінок (p<0,001). У подальшому частота хворих на ІМ і ЦД 2 типу зростає і при цьому суттєво збільшується частка жінок. Зокрема, у віковому періоді 61-75 років ІМ і ЦД 2 типу виявлено у 95 (56,5%) жінок і 78 (41,5%) чоловіків (p<0,01). У старечому віці (від 75 років) питома вага жінок із поєднаною патологією перевищує вдвічі таку у чоловіків (р<0,05).
Госпітальна летальність серед хворих на ІМ і ЦД 2 типу вдвічі вища, ніж без ЦД (відповідно 23,2% і 12,1%). Серед жінок вона становила 24,4%, у чоловіків досягала 22,0%, що майже вдвічі більше ніж у групах пацієнтів відповідної статі без ЦД (відповідно 14,1% і 10,8%; р<0,01). Найпоширенішою безпосередньою причиною смерті пацієнтів із ЦД 2 типу був кардіогенний шок (33,3% жінок і 34,6% чоловіків), який у більшості випадків ускладнював перебіг первинного трансмурального або циркулярного ІМ. Другою за частотою причиною смерті виявилась застійна СН (26,7% жінок і 23,1% чоловіків), яка виникала переважно у хворих із повторним ІМ та частими рецидивами лівошлуночкової недостатності при первинному ІМ.
Аналіз клінічних проявів у період маніфестації ІМ засвідчив, що у значної частини хворих виникала передінфарктна стенокардія та інші продромальні симптоми. У жінок, порівняно із чоловіками, фон, на якому розвинувся ІМ, був значно важчим. Зокрема, стенокардія напруження в анамнезі зазначалась у 61,3% жінок і 50,5% чоловіків (р<0,05), АГ – 91,1% і 73,4 % відповідно (р<0,001). Більше ніж у 30% хворих на ЦД 2 типу ІМ розвивався повторно. Повторний ІМ встановлено у 36,7% чоловіків та у 39,9% жінок, що достовірно перевищувало аналогічні показники у хворих без ЦД (26,8% та 31,5% відповідно; р<0,05). Саме в осіб із ЦД 2 типу зазначено високу ймовірність розвитку повторного ІМ впродовж першого року. У жінок вона була вищою, ніж у чоловіків (41,7% та 36,2% відповідно; р>0,05). За даними проведеного дослідження, частка пацієнтів з ожирінням (ІМТ більше 30,0 кг/м2 ) серед хворих на ІМ і ЦД 2 типу становить 47,5%. Окрім того, у 40,0% осіб з ІМ і супутнім ЦД 2 типу виявлено надлишкову вагу. Серед жінок надлишкова вага й ожиріння спостерігались у 95,1% осіб, серед чоловіків – у 81,6% (p<0,001).
За даними клінічного спостереження у групі хворих із ЦД 2 типу ІМ вперше розвинувся у 60,1% жінок і 63,3% чоловіків. З них QS-ІМ спостерігався в 48,2% жінок і 44,7% чоловіків. Більше ніж у третини всіх хворих відмічали розвиток Q-ІМ, приблизно у кожного восьмого – ІМ без зубця Q (13,7% жінок і 13,3% чоловіків). Водночас, дуже складно, а іноді неможливо, визначити глибину ураження ІМ у хворих із супутнім ЦД через значну частку повторних ІМ. Аналіз локалізації вогнищ некрозу в міокарді загалом засвідчив відсутність істотної відмінності щодо розвитку ІМ по передній чи задній стінках ЛШ у чоловіків та жінок. Характерним було те, що у більшості хворих, незалежно від статі, зазначали одночасне ураження декількох стінок ЛШ. Виявлена особливість є свідченням поширеного, множинного ураження артерій у осіб із ЦД 2 типу, які тривалий час зазнають впливу гіперглікемії. Додатковим підтвердженням цього є частіший розвиток у них тромбоішемічного інсульту, як наслідку втягнення у процес інших судинних басейнів. Перенесений інсульт, переважно за ішемічним типом, встановлено у 11,9% чоловіків, що значно перевищувало відповідний показник у жінок 5,9% (p<0,05).
У 27,9% жінок і 19,1% чоловіків початок ІМ на фоні ЦД 2 типу був атиповим. Атипові прояви на початку ІМ відзначались частіше у жінок, ніж у чоловіків (p<0,05). Серед атипових форм переважав астматичний, малосимптомний, безбольовий варіанти дебюту ІМ. У більшості хворих на ЦД 2 типу було встановлено поєднання класичного ангінозного нападу і вираженого астматичного варіантів – 64,3% жінок та 52,1% чоловіків, p<0,05. Відсутність типового болю за грудиною у хворих на ІМ із супутнім ЦД 2 типу зумовила те, що лише 72,0% жінок та 77,1% чоловіків були госпіталізовані у перший день розвитку хвороби.
Ризик розвитку ускладнень у хворих з ІМ значно підвищувався за умови наявності у них супутнього ЦД 2 типу. У хворих з ІМ і ЦД 2 типу частіше ніж у пацієнтів на ІМ без ЦД у дебюті захворювання виникала гостра лівошлуночкова недостатність – відповідно 57,9% і 40,9% осіб (р<0,01), переважно ІІ ступеня за Killip. Вона розвивалась у 1,9 рази частіше у пацієнтів із ІМ і ЦД 2 типу, ніж у недіабетичних хворих (р<0,002). У переважній більшості випадків гостра СН у подальшому трансформувалася у застійну СН, яка спостерігалась у кожного третього пацієнта з ІМ і ЦД 2 типу та лише у кожного шостого – без ЦД 2 типу (p<0,05). У частини пацієнтів прогресування застійної СН призводило до появи плеврального випоту, який частіше виявляли у хворих із ЦД 2 типу, ніж без діабету (11,8 % і 2,2 % відповідно; р<0,05), та виникнення гідроперикарду (4,2 % і 1,1 % відповідно; р<0,05). Аналіз виявлення низки ускладнень ІМ: загрозливих для життя аритмій – фібриляції шлуночків, шлуночкової тахікардії, пароксизмів надшлуночкової тахікардії, блокад ніжок пучка Гіса, рецидивів ІМ, постінфарктної стенокардії тощо, засвідчив відсутність значних відмінностей між цими показниками у хворих обох груп.
Оцінка стану вуглеводного обміну показала, що тривалість ЦД 2 типу у хворих на ІМ становила в середньому 7,5 років (від 1 до 30 років). Частка пацієнтів із тривалістю ЦД 2 типу до 5-ти років була високою і складала 53,4%, що є ще одним аргументом прискорення розвитку ІМ за наявності ЦД. Значно менше було пацієнтів, які мали в анамнезі ЦД 2 типу від 5-ти до 10-ти років та більше 10-ти років. Зокрема, тривалість ЦД 2 типу від 5-ти до 10-ти років констатовано у 47 (22,8%), а більше 10-ти років – у 49 (23,8%) осіб. За рівнем НbА1С компенсація ЦД 2 типу у жінок була істотно нижчою, порівняно із чоловіками: у жінок середній рівень НbА1С становив 9,62±0,31%, у чоловіків – 8,79±0,24%, р<0,01.
У 43,6% хворих на ІМ вперше виявлено підвищений рівень глюкози. У ході дослідження був розроблений і апробований спосіб визначення рівня НbА1С , з метою диференціації «стресової» гіперглікемії та недіагностованого раніше вперше виявленого ЦД 2 типу. Запропоновані критерії: при рівні НbА1С нижче 7,0% діагноз ЦД заперечується, підвищення рівня понад 7,0% свідчить про наявність ЦД або ПТГ, що розвинулися ще задовго до виникнення ІМ (принаймні до 3-х місяців).
Вперше виявлений ЦД 2 типу або ПТГ діагностовано у 26,0% обстежених (рис. 1).
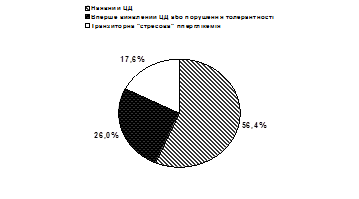
Рис. 1. Розподіл хворих із гіперглікемією в гострий період ІМ за результатами визначення вмісту НbА1С у крові.
Як засіб діагностики вперше виявленого ЦД 2 типу, визначення вмісту НbА1С найбільш інформативне у випадках, коли його рівень значно перевищує норму. Зокрема, за відсутності даних щодо ЦД в анамнезі в обстежених хворих цієї групи він становив 8,1–17,9% (в середньому – 9,9±0,48%). При регулярному контролі глікемії під час лікування в стаціонарі також стабільно фіксували високий рівень глюкози крові (в середньому – 8,6±1,0 ммоль/л). На нашу думку, це свідчить про наявність у цих пацієнтів ЦД 2 типу. У 17,6% хворих констатовано гіперглікемію, зумовлену стресовою реакцією на розвиток ІМ. У цих хворих НbА1С був у межах норми (до 7,0%). Незважаючи на наявність гіперглікемії протягом перших діб, діагноз ЦД не підтверджувався і потреби у призначенні гіпоглікемізуючої терапії не було. Така інтерпретація результату тесту на НbА1С надалі повністю себе виправдала. Рівень глікемії в цих хворих протягом найближчого тижня нормалізувався.
Результати проведеного дослідження засвідчили, що більш ніж у 80% пацієнтів з ІМ і ЦД 2 типу виявлено значне відхилення від цільових значень показників ліпідного обміну
, рекомендованих ESC і
8-09-2015, 22:13
