Встановлено, що абсолютний рівень ЗХС, ХС ЛПНГ, ТГ достовірно вищий у пацієнтів на ІМ і ЦД 2 типу, порівняно із хворими на ІМ без ЦД. Лише у 8,3% пацієнтів із гострим ІМ і ЦД 2 типу рівень основного атерогенного показника ХС ЛПНГ відповідав цільовому (<2,5 ммоль/л), а ТГ були в межах норми (<1,7 ммоль/л), що достовірно рідше ніж у пацієнтів без ЦД 2 типу (17,7%). Надмірне патологічне підвищення ЗХС понад 6,2 ммоль/л, ХС ЛПНГ – вище 4,1 ммоль/л, ТГ – вище 2,0 ммоль/л виявлялось у значно більшої кількості хворих із ЦД, ніж в осіб без ЦД (p<0,01). Гіпертригліцеридемію (рівень ТГ>2,0 ммоль/л) відмічали в половини з усіх хворих зі ЦД і майже в третини пацієнтів на ІМ без ЦД (p<0,05). Патологічне зниження антиатерогенного ХС ЛПВГ (нижче 1,0 ммоль/л) і підвищення ТГ (вище 2,0 ммоль/л) виникало у 2,4 рази частіше у хворих на ЦД 2 типу, ніж без ЦД (p<0,05).
Результати аналізу порушень ліпідотранспортної системи залежно від наявності чи відсутності ЦД 2 типу свідчать про значне зростання апо-В в обох групах хворих на ІМ, але в більшій мірі серед хворих з ЦД. Зокрема, рівень апо-В у крові цих пацієнтів був на 27,3% достовірно вищим, ніж у обстежених на ІМ без ЦД (відповідно 2,16±0,16 і 1,57±0,14 г/л, p<0,05). Збільшення рівня апо-В, що перевищує припустимі межі норми, удвічі частіше (1,82 г/л у жінок і 1,86 г/л у чоловіків) спостерігалось серед пацієнтів на ІМ і ЦД, ніж у хворих без ЦД (відповідно у 44,8% і 21,1% осіб, p<0,01). Щодо протиатерогенного захисту, то відмінності у рівнях апо-А залежно від наявності супутнього ЦД не зазначено. Рівень апо-А в однаковій мірі патологічно знижений у пацієнтів на ІМ як із ЦД, так і без нього.
При порівнянні показників ліпідного обміну за приналежністю до певної статі підтверджено більш виражений атерогенно змінений обмін у жінок. Зокрема, якщо серед пацієнток з ІМ та ЦД 2 типу середній рівень ЗХС становив 6,16±0,22 ммоль/л, то в групі чоловіків із таким же діагнозом – 5,32±0,15 ммоль/л, р<0,001; ХС ЛПНГ – відповідно 4,00±0,21 і 3,25±0,13 ммоль/л, р<0,001; КА – 4,55±0,30 та 3,66±0,17 од, р<0,01; ХМ – 2,27±0,11 і 2,02±0,07%, р<0,05; ХС не-(ЛПВГ) – 4,90±0,24 і 4,11±0,15 ммоль/л, р<0,01; апо-В – 2,03±0,12 і 1,72±0,12 г/л, р<0,05. Хоч такі показники, як ХС ЛПДНГ, ТГ, індекс ТГ/ЛПВГ, коефіцієнт апо-В/апо-А були вищими, а ХС ЛПВГ і апо-А – нижчими серед жінок, проте, відмінність за приналежністю до певної статі виявилась статистично недостовірною.
Надмірно підвищений ЗХС понад 6,2 ммоль/л, ХС ЛПНГ – вище 4,1 ммоль/л, ТГ – вище 2,0 ммоль/л виявляли у 2,5 рази частіше у жінок, ніж у чоловіків (p<0,05). Виражену гіперхолестеринемію відзначали в кожної третьої жінки та в кожного п’ятого чоловіка (p<0,05). Характерна ознака діабетичної дисліпідемії (ДЛП) – патологічне зниження антиатерогенного ХС ЛПВГ (нижче 1,0 ммоль/л у чоловіків і 1,2 ммоль/л у жінок) та підвищення ТГ (вище 2,0 ммоль/л), також була більш властива жінкам. В останніх її констатували в п’ять разів частіше, ніж у чоловіків (p<0,001).
Відстежено взаємозв’язок між вираженістю порушень вуглеводного обміну, критерієм якого є патологічно підвищений рівень НbА1С , та змінами ліпідного спектру крові в пацієнтів із гострим ІМ та ЦД 2 типу. У хворих із рівнем НbА1С понад 10%, порівняно із групою пацієнтів з НbА1С у межах 7–8%, рівень ЗХС був вищий на 13,9%, ХС ЛПНГ – на 20,8%, ХС ЛПДНГ – на 20,7%, КА – на 32,4%, ТГ – на 18,6%, ХМ – на 19,1%, ХС не-(ЛПВГ) – на 21,8%, а рівень ХС ЛПВГ був знижений на 10,0% (усі відмінності достовірні, р<0,05).
Проаналізовано ліпідний спектр крові залежно від наявності АГ. Встановлено, що середні рівні основних показників ліпідного спектру крові у пацієнтів з АГ значно перевищують аналогічні в осіб без АГ. Наприклад, якщо в групі пацієнтів без АГ середній рівень ЗХС становить 4,87±0,21 ммоль/л, то в групі хворих з АГ – 5,80±0,22 ммоль/л (р<0,05); ХС ЛПНГ – відповідно, 3,03±0,39 ммоль/л і 3,84±0,21 ммоль/л (р<0,05); ХС ЛПДНГ – 0,78±0,04 і 0,89±0,03 ммоль/л (р<0,05); ТГ – 1,73±0,08 і 1,99±0,07 ммоль/л (р<0,05); ХС не-(ЛПВГ) – 4,11±0,31 і 4,90±0,15 ммоль/л (р<0,05); КА – 3,44±0,35 і 4,33±0,33 од (р<0,05); індекс ЗХС/ХС ЛПВГ – 4,24±0,16 і 5,00±0,16 од (р<0,05); індекс ТГ/ХС ЛПВГ – 1,53±0,06 і 1,76±0,06 од (р<0,05) індекс ХС ЛПНГЧТГ – 7,78±0,56 і 5,89±0,36 од (р<0,05).
У пацієнтів з ІМ і ЦД 2 типу ступінь ожиріння, на відміну від порушення вуглеводного обміну та наявності АГ, суттєво не впливав на вираженість атерогенних змін ліпідного спектру крові.
Результати проведеного дослідження показали, що у пацієнтів на ІМ і ЦД 2 типу існує взаємозв’язок між вираженістю змін показників ліпідного обміну, які належать до різних класів. Зокрема, зростання холестеринвмісних показників спричиняло погіршення тригліцеридвмісних, і навпаки. У цих хворих зазначено помірну кореляційну залежність між ЛПНГ і ТГ (r=0,4). Враховуючи встановлені закономірності, для проведення оцінки ліпідного обміну впродовж виконання дослідження також розроблено і запропоновано індекс ХС ЛПНГЧТГ, який одночасно характеризує холестериновий і тригліцеридний обмін. Рівень індексу ХС ЛПНГЧТГ нижче 4,3 одможе свідчити про ефективність медикаментозної корекції ДЛП у хворих на ІМ із ЦД 2 типу.
Серед обстежених хворих на ІМ із супутнім ЦД 2 типу інсулінорезистентність за індексом HOMA більше 2,9 ум од діагностували у 48,8% осіб. Проведене дослідження засвідчило значно гіршийстан вуглеводного обміну у хворих на ІМ і ЦД 2 типу з ІР. Зокрема, у групі з ІР, порівняно без ІР, рівень глікемії був вищим на 34,8% (р<0,05), НbА1С – на 11,1% (р<0,05), індексу НОМА – у 4,5 рази, інсуліну – у 3 рази. Індекс QUICKI, відповідно, виявився нижчим на 26,8%, індекс McAuley – на 40,7%, індекс Caro – у 5,2 рази (рис. 2). Достовірної різниці щодо тривалості ЦД 2 типу між групами встановлено не було (відповідно 4,83±1,24 та 5,96±1,33 роки).
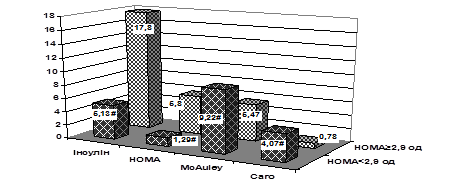
Рис. 2. Показники інсулінорезистентності у хворих на ІМ і ЦД 2 типу залежно від рівня індексу HOMA.
Виявилось, що найсуттєвіші зміни ліпідного спектру крові спостерігали в осіб, у яких діагностовано ІР. І навпаки, найменш виражені прояви ДЛП відзначались у пацієнтів, у яких рівень імунореактивного інсуліну, індекси HOMA, QUICKI, McAuley та Caro не вказували на наявність ІР. У порівнянні з пацієнтами без ІР, рівень ЗХС у групі з ІР був вищий на 19,0% (р<0,05), ХС ЛПНГ – на 24,3% (р<0,05), ХС ЛПДНГ – на 21,7% (р<0,05), КА – на 30,2% (р<0,05), ТГ – на 24,8 % (р<0,05), ХС не-(ЛПВГ) – на 25,9% (р<0,05), ХМ – на 28,2% (р<0,05), апо-В – на 25,7% (р<0,05). При цьому рівень ХС ЛПВГ, апо-А та індекс апо-В/апо-А змінювалися недостовірно.
На думку K.A. McAuley та співавторів (2001), найкращим способом виявлення ІР у загальній популяції населення є розрахунок індексу, що базується на визначенні рівнів ТГ та інсуліну натще. Результати проведеного дослідження вказують, що існує достовірний зворотний зв’язок між індексом McAuley та концентрацією СРБ (r= –0,44; p<0,01), ФНП-б (r= –0,28; p<0,05), а також прямий – із ІЛ-4 (r=0,23; p<0,05). Щодо ЗФ, то між останнім та індексом McAuley достовірного зв’язку не спостерігалось. Результати дослідження також вказують, що існує достовірний зворотний зв’язок між індексом McAuley та концентрацією в крові таких ліпідних показників, як ЗХС (r= –0,51; p<0,01), ХС ЛПНГ (r= –0,47; p<0,01), ХС ЛПДНГ(r= –0,64; p<0,01), КА (r= –0,51; p<0,01), ТГ (r= –0,64; p<0,01), ХС не-(ЛПВГ) (r= –0,52; p<0,01), ХМ (r= –0,65; p<0,01), Aпо-В (r= –0,37; p<0,01), індексом ЗХС/ХС ЛПВГ (r= –0,51; p<0,01), індексом ТГ/ХС ЛПВГ (r= –0,61; p<0,01). Щодо ХС ЛПВГ, апо-А, то між останніми та індексом McAuley достовірного зв’язку не спостерігалось.Таким чином, ІР взаємопов’язана з порушеннями ліпідного обміну та активацією системного запалення.
Частота виявлення ІР була у 1,8 рази більша у жінок ніж у чоловіків (67,5% і 37,3% відповідно, р<0,05) та у 2 рази більша в осіб з АГ ніж у пацієнтів без АГ (58,6 % і 27,2 % відповідно, р<0,05).
Результати проведеного дослідження показали, що у хворих на ІМ і ЦД 2 типу при виявленні ІР значно гірший перебіг ІМ на тлі ЦД 2 типу. Зокрема, лише у 17,5% пацієнтів на ІМ з ІР (2-а група) спостерігався неускладнений перебіг ІМ, що значно рідше, ніж серед хворих на ІМ без ІР (1-а група) – 36,5% (р<0,05). Порівняно з пацієнтами 1-ї групи, у хворих з ІР (2-а група) частіше виникали постінфарктна стенокардія (відповідно 27,5% і 7,3%). Достовірно встановлено, що у пацієнтів з ІР частіше виявлялась супутня АГ. Інфаркт міокарда супроводжувався суттєвим зростанням артеріального тиску при госпіталізації, а також періодичним підвищенням впродовж стаціонарного етапу лікування.
Дослідження лептину у хворих на ІМ із супутнім ЦД 2 типу засвідчило, що у частини пацієнтів його рівень у сироватці крові перевищував контрольні показники. Інша частина пацієнтів, навпаки, мала знижений рівень лептину. Залежно від зростання чи зниження вмісту лептину відносно контрольних показників хворі на ІМ і ЦД 2 типу були розділені на групи: 1-а група – середній рівень лептину становив 6,91±0,56 нг/мл і був значно нижчий від контролю 9,97±0,77 нг/мл; 2-а група – пацієнти з вищим рівнем лептину 14,41±0,98 (нг/мл), ніж у контролі. Ознаки ДЛП були найбільш вираженими в осіб 1-ї групи, у яких виявлено нижчий рівень лептину, ніж у контролі. Зокрема, порівняно з 2-ю групою, рівень ЗХС у 1-й групі був вищий на 30% (p<0,05); ХС ЛПНГ – на 38,2% (p<0,05); ХС ЛПДНГ – на 37,9% (p<0,05); КА – на 51,6% (p<0,05); ТГ – на 37,4% (p<0,05); ХС не-(ЛПВГ) – на 41,7% (p<0,05); ХМ – на 32,5% (p<0,05); індекс ЗХС/ХС ЛПВГ – на 37,8% (p<0,05); індекс ТГ/ХС ЛПВГ – на 45,9% (p<0,05); апо-В – на 24,2% (p<0,05). Рівень ХС ЛПВГ та апо-А змінювався недостовірно.
У групі хворих із зниженим рівнем лептину (1-а група), порівняно з особами з підвищеним його вмістом (2-а група), показники метаболізму NO та системного запалення змінювались більш суттєво. Зокрема, у хворих 1-ї групи рівень Total NO становив 100,49±9,41 мкмоль/л, у той час як у пацієнтів 2-ї групи – 81,17±9,50 мкмоль/л (р<0,05); рівень ФНП-б – відповідно 102,66±11,89 пг/мл та 68,87±9,22 пг/мл (р<0,05); рівень ІЛ-4, відповідно – 12,28±0,89 пг/мл і 8,20±0,55 пг/мл (р<0,05); рівень СРБ, відповідно – 9,56±0,56 мг/л і 6,87±0,62 мг/л (р<0,05).
Хоч рівень НbА1С достовірно не відрізнявся між групами порівняння, проте серед пацієнтів на ІМ і ЦД 2 типу гірший стан показників ІР виявлено в 1-й групі. І навпаки, найменш виражені прояви погіршення обміну інсуліну спостерігались у пацієнтів 2-ї групи із гіперлептинемією. У 1-й групі, порівняно з 2-ю групою, були вищими рівні індексів HOMA, Bennetta та імунореактивного інсуліну, і нижчими – рівні індексів QUICKI, McAuley. Зокрема, у 1-й групі, порівняно з 2-ю групою, рівень інсуліну та індекс НОМА були вищими у 2 рази (р<0,05), а індекс Bennetta – на 63% (р<0,05). У цій же групі індекс QUICKI був нижчим на 15,2% (р<0,05), індекс McAuley – на 37,0% (р<0,05).
Хворі на ІМ і ЦД 2 типу з ожирінням достовірно частіше реєструвались у 1-й групі (61,2%), порівняно з особами 2-ї групи (33,3%). Крім того, у даній роботі виявлено достовірний зворотний кореляційний зв’язок між лептином та ІМТ (r= –0,27; р<0,05).
Результати дослідження метаболізму NO показали, що незалежно від наявності чи відсутності ЦД 2 типу, у обстежених пацієнтів у першу добу гострого ІМ відзначали зростання рівня Total NO. Середній вміст цього показника достовірно (р<0,001) перевищив його рівень у контрольній групі. Крім того, встановлено, що у хворих з ІМ та ЦД 2 типу, а також – з ІР, порівняно із хворими на ІМ без ЦД, цей показник зростав ще в більшій мірі. Зокрема, у хворих на ІМ і ЦД 2 типу рівень Total NO становив 89,66±5,07 мкмоль/л, у пацієнтів на ІМ і ЦД з ІР (HOMA>2,9 ум. од) – 105,15±10,75 мкмоль/л, у хворих на ІМ без ЦД – 58,81±6,44 мкмоль/л (р<0,05) (табл. 2).
Таблиця 2
Показники системного запалення та метаболізму оксиду азоту у пацієнтів
з ІМ залежно від наявності ЦД 2 типу та інсулінорезистентності
| Показники | Контроль (n=11) | ІМ без ЦД 1-а група (n=27) |
ІМ із ЦД 2-а група (n=62) |
ІМ з ІР, 3-я група (n=28) |
| Total NO (мкмоль/л) | 21,62±1,23 | 58,81±6,44 | 89,66±5,07* | 105,15±10,7 * # |
| СРБ (мг/л) | 2,92± 0,28 | 6,52± 0,58 | 6,83± 0,66 | 10,04±0,76 * # |
| ФНП-б (пг/мл) | 2,36± 0,16 | 43,23± 6,59 | 85,79± 5,07* | 100,15±10,75 * # |
| ІЛ-4 (пг/мл) | 4,69± 0,38 | 8,85± 1,19 | 10,62± 0,67 | 9,58±1,08 |
| ЗФ (г/л) | 2,37± 0,12 | 3,13± 0,19 | 3,83± 0,13 * | 4,18±0,16 *# |
Примітки:
1. * p<0,05 – достовірність різниці, у порівнянні з показниками 1-ї групи;
2. # p<0,05 – достовірність різниці, у порівнянні з показниками 2-ї групи.
Рівень Total NO був достовірно вищий при передній локалізації ІМ, порівняно із задньою (відповідно 92,62±6,6 мкмоль/л і 74,56±5,69 мкмоль/л, р<0,05); у жінок, порівняно із чоловіками (відповідно 98,31±7,41 мкмоль/л і 80,09±5,63 мкмоль/л, р<0,05), у хворих віком понад 60 років, порівняно з молодшими 60 років (відповідно 109,51±7,78 мкмоль/л і 80,16±6,10 мкмоль/л, р<0,05), при концентрації НbА1С >8%, порівняно з НbА1С <8%, (відповідно 103,10±6,37мкмоль/л і71,32±6,60 мкмоль/л, р<0,05).
Встановлено прямий достовірний зв’язок між Total NO та показниками системного запалення: концентрацією СРБ (r=0,48; p<0,01), ФНП-б (r=0,64; p<0,01), ЗФ (r=0,34; p<0,05). Щодо показника системного запалення ІЛ-4 – цитокіну, який має одночасно про- та протизапальні властивості, то між ним та Total NO достовірного зв’язку не відзначали. Аналіз кореляцій Total NO та МДА (r=0,78; p<0,01) підтвердив його тісний зв’язок із процесами ПОЛ. У роботі продемонстровано достовірний прямий зв’язок між Total NO та концентрацією у крові ЗХС (r=0,23; p<0,05), ХС ЛПНГ (r=0,24; p<0,05), КА (r=0,27; p<0,05), індексом ЗХС/ХС ЛПВГ (r=0,27; p<0,05), апо-В (r=0,37; p<0,05). Виявлено достовірний зворотний зв’язок між Total NO та показником ліпідного спектру крові – ХС ЛПВГ (r= –0,33; p<0,05). Проте, не всі показники ліпідного спектру крові достовірно корелювали із рівнем Total NO. Достовірного зв’язку між ним та рівнями ТГ, апо-А не встановлено.
В обстежених хворих на гострий ІМ із ЦД 2 типу із погіршенням вуглеводного обміну та наростанням ІР підвищується рівень Total NO, про що свідчить позитивна кореляція між ним та концентрацією у крові основних показників вуглеводного обміну – глюкозою (r=0,47; p<0,01), НbА1С (r=0,39; p<0,01), індексом HOMA (r=0,21; p<0,05), C-пептидом (r=0,33; p<0,01).
В обстежених пацієнтів у першу добу гострого ІМ відзначали зростання показників системного запалення – ФНП-б, ІЛ-4, СРБ, ЗФ (табл.2). Середній вміст усіх цих показників достовірно (р<0,001) перевищив аналогічні у контрольній групі. Однак, у хворих з ІМ та ЦД 2 типу (2-а група), а також з ІР (3-я група), порівняно з особами без ЦД (1-а група), показники системного запалення змінювались більш суттєво. Зокрема, у хворих 2-ї групи рівень ФНП-б становив 85,79±5,07 пг/мл, у пацієнтів 3-ї групи – 100,15±10,75 пг/мл, у той час, як у пацієнтів 1-ї групи – 43,23±6,59 пг/мл (р<0,001); концентрація ЗФ, відповідно – 3,83±0,13 г/л, 4,18±0,16 г/л і 3,13±0,19 г/л (р<0,05). У хворих 2-ї та 3-ї груп, порівняно із 1-ю групою, спостерігався вищий рівень ІЛ-4 – відповідно 10,62±0,67 пг/мл, 9,58±1,08 пг/мл і 8,85±1,19 пг/мл, та СРБ, відповідно – 6,83±0,66 мг/л, 10,04±0,76 мг/л і 6,52±0,58 мг/л. Проте, достовірної різниці між хворими із ІМ і ЦД (2-а й 3-тя група) та пацієнтами із ІМ без ЦД виявлено не було. Однак, найсуттєвіше достовірне зростання показників системного запалення (ФНП-б на 16,7% (р<0,05), СРБ на 46,9% (р<0,001), ЗФ на 9,1% (р<0,05), порівняно з пацієнтами 2-ї групи), відзначали насамперед у хворих на ІМ та ЦД 2 типу з ІР (HOMA>2,9 ум. од) (3-я група). Ймовірно, що наявність ІР поглиблює системне запалення.
Результати аналізу показників ПОЛ та антиоксидантного захисту засвідчили, що у пацієнтів із ЦД 2 типу ІМ виникає на фоні важкого оксидативного стресу. Встановлено, що у хворих на ІМ із супутнім ЦД 2 типу середньогрупові рівні основних показників ліпопероксидації зростають помітніше, ніж у пацієнтів на ІМ без ЦД 2 типу. Зокрема, якщо в групі хворих на ІМ і ЦД 2 типу рівень МДА становив 4,95±0,07, то в групі без ЦД – 4,63±0,09 нмоль/мл, р<0,02; ДКп відповідно – 4,58±0,11 та 3,86±0,17 нмоль/мл, р<0,01.
Зниження показників антиоксидантної системи
в осіб із ЦД 2 типу досягло достовірності, порівняно з пацієнтами без ЦД. Зокрема, у пацієнтів
8-09-2015, 22:13
